1 . 已知第四周期过渡金属元素M,其六氨合M盐与氨化钾溶液在液氨中反应生成棕色非晶态的A[含三种元素,其中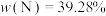 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
(1)请计算推断出M______ 、A______ 、B______ ;
(2)写出反应方程式(Ⅰ)______ 、(Ⅱ)______ 。(提示:可以从最简单的情况开始考虑)
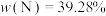 ],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中
],它能溶解在过量氨化钾溶液中,可能生成了一双核络合阴离子B[带三个负电荷,含三种元素,其中 ]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。
]。A在高压釜中与硝酸铵溶液一起加热至100℃则又再生成六氨合M盐(Ⅰ)。在室温下A缓慢释放出氨气并生成MN(Ⅱ)。(1)请计算推断出M
(2)写出反应方程式(Ⅰ)
您最近一年使用:0次
解题方法
2 . 下表列出了A~M 13种元素在周期表中的位置:
(1)这些元素中,金属性最强的元素是_______ (填元素符号,下同),非金属性最强的是_______ 。
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式_______ 。
(3)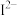 、
、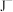 、
、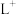 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是_______ ,最小的是_______ 。
(4)A与D形成的化合物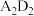 是
是_______ 化合物,其电子式为_______ 。
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
(2)写出H元素的最高价氧化物与F元素最高价氧化物对应水化物反应的离子方程式
(3)
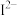 、
、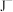 、
、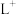 、
、 等微粒中,半径最大的是
等微粒中,半径最大的是(4)A与D形成的化合物
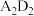 是
是
您最近一年使用:0次
22-23高一下·上海浦东新·期中
名校
解题方法
3 . 元素周期表是元素周期律的具体表现,是学习和研究化学的一种重要工具。下图是元素周期表的一部分:
回答下列问题:
(1)As元素在周期表中的位置是:___________ 。
(2)元素①气态氢化物分子的空间构型是___________ 。请用一个方程式比较元素①和元素②的非金属性强弱:___________ 。
(3)元素③、④、⑤的简单离子半径由大到小排序为:___________ (用离子符号表示)。
(4)元素⑤、⑥非金属性更强的是:___________ (用元素符号表示),请从原子结构的角度解释:___________ 。
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能( ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
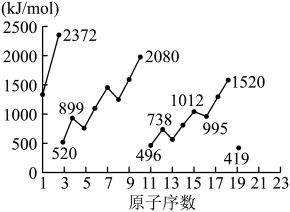
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
(6)10号元素Ne的 值较大的原因是
值较大的原因是___________ 。
| ① | ② | ③ | ||
| ④ | P | ⑤ | ⑥ | |
| Ga | Ge | As | Se | Br |
回答下列问题:
(1)As元素在周期表中的位置是:
(2)元素①气态氢化物分子的空间构型是
(3)元素③、④、⑤的简单离子半径由大到小排序为:
(4)元素⑤、⑥非金属性更强的是:
电离能是指由气态原子失去电子形成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能(
 ),失去第二个电子所需要的能量为第二电离能(
),失去第二个电子所需要的能量为第二电离能( ),依次类推。下图为1-19号元素第一电离能
),依次类推。下图为1-19号元素第一电离能 。
。
回答下列问题:
(5)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常,预测下列关系式中正确的是___________(填编号)。
A.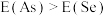 | B. | C. | D.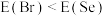 |
 值较大的原因是
值较大的原因是
您最近一年使用:0次
4 . 元素周期表中,铍(Be)与铝处于对角线的位置,它们的性质相似。试回答:
(1)Be元素在元素周期表中的位置:___________ ,有关Be性质的推断不正确的是___________ (填序号)。
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时, 溶液的
溶液的
(2)已知: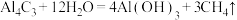 ,写出
,写出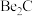 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为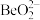 ):
):___________
(3)基态铝原子的价电子排布式为___________ ,镁铝合金经过高温淬火获得一种储钠材料,用___________ 法测定其晶胞结构如图1所示,图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为___________ ,该立方晶胞的晶胞的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为___________ pm。(列出计算式,可不化简)。
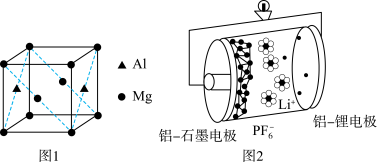
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为: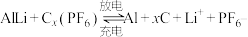 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为___________ ,充电时,应将铝-石墨电极与外接电源的___________ 极相连。
(1)Be元素在元素周期表中的位置:
a.Be是一种轻金属,能与冷水反应
b.氧化铍具有高熔点,能耐酸碱
c.常温时,
 溶液的
溶液的
(2)已知:
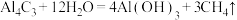 ,写出
,写出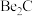 与NaOH溶液反应的离子方程式(铍酸根离子为
与NaOH溶液反应的离子方程式(铍酸根离子为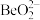 ):
):(3)基态铝原子的价电子排布式为
 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则该晶胞中镁铝之间的最近距离为
,则该晶胞中镁铝之间的最近距离为
(4)铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为:
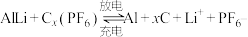 ,电池结构如图2所示。放电时,正极反应式为
,电池结构如图2所示。放电时,正极反应式为
您最近一年使用:0次
5 . 按照要求回答下列问题。
(1)有下列物质: 、
、 、
、 、
、 、
、 、
、 、
、 。
。
①上述物质中既含共价键又含离子键的__________ ;属于共价化合物的是__________ ;
② 溶于水时破坏
溶于水时破坏__________ (填“共价键”或“离子键”,下同), 熔化时破坏
熔化时破坏__________ 。
(2)砷在元素周期表中的位置__________ 。原子序数为115的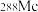 中子数为
中子数为__________ 。
(3)向 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为__________ 。可证明非金属性:
__________ S(填“>”或“<”)。
(4)短周期元素Y的一种含氧酸化学式为 ,其结构式可表示为
,其结构式可表示为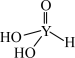 。该酸为
。该酸为__________ 元酸。写出该酸与过量 溶液反应的化学方程式:
溶液反应的化学方程式:__________ 。(用对应元素符号作答。已知信息:氢氧原子结合成的一种原子团“ ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
(1)有下列物质:
 、
、 、
、 、
、 、
、 、
、 、
、 。
。①上述物质中既含共价键又含离子键的
②
 溶于水时破坏
溶于水时破坏 熔化时破坏
熔化时破坏(2)砷在元素周期表中的位置
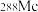 中子数为
中子数为(3)向
 溶液中通入氯气出现黄色浑浊,反应的离子方程式为
溶液中通入氯气出现黄色浑浊,反应的离子方程式为
(4)短周期元素Y的一种含氧酸化学式为
 ,其结构式可表示为
,其结构式可表示为 。该酸为
。该酸为 溶液反应的化学方程式:
溶液反应的化学方程式: ”叫羟基,含氧酸中只有羟基氢才可电离出
”叫羟基,含氧酸中只有羟基氢才可电离出 )
)
您最近一年使用:0次
2023-03-24更新
|
649次组卷
|
3卷引用:河南省南阳市六校2022-2023学年高一下学期第一次联考化学试题
2023高三·全国·专题练习
解题方法
6 . 元素周期表中的数量应用
(1)甲、乙是元素周期表中同一周期的第ⅡA族和第ⅦA族元素,原子序数分别为m、n,则m、n的关系为_______ 。
(2)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是_______ 。
(3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为_______ 。
(4)下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是_______。
(1)甲、乙是元素周期表中同一周期的第ⅡA族和第ⅦA族元素,原子序数分别为m、n,则m、n的关系为
(2)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是
(3)若A、B是相邻周期同主族元素(A在B的上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为
(4)下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为37的是_______。
A. | B.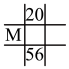 | C.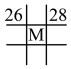 | D.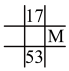 |
您最近一年使用:0次
7 . 某学习小组探究B及其化合物的性质。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。
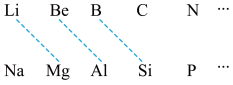
B在元素周期表中的位置是_______ 。其最高价氧化物的化学式为_______ ,与氢氧化钠溶液反应的化学方程式为_______ 。
(2)某科研团队研究发现硼氢化钠( )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
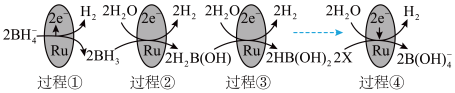
①上图中X的化学式为_______ 。
② 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用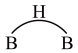 表示,则二聚物结构式为
表示,则二聚物结构式为_______ 。
③图中反应的总化学方程式为_______ 。
④_______ g 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。

B在元素周期表中的位置是
(2)某科研团队研究发现硼氢化钠(
 )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
①上图中X的化学式为
②
 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用 表示,则二聚物结构式为
表示,则二聚物结构式为③图中反应的总化学方程式为
④
 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
您最近一年使用:0次
8 . 铅的合金可作轴承、电缆外皮之用,还可做体育器材铅球等。
(1)铅元素位于元素周期表第六周期IVA族,该族中原子序数最小的元素的原子有_______ 种 能量不同的电子,其次外层的电子云有_______ 种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是_______ (填化学式),气态氢化物沸点最低的是_______ (填电子式)。
(3)配平下列化学方程式,把系数以及相关物质填写在空格上,并标出电子转移的方向和数目______ 。
_______PbO2+_______MnSO4+______HNO3→_______HMnO4+______Pb(NO3)2+_______PbSO4↓+_______
(4)把上述反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol·L-1,则反应中转移的电子数为_______ 个,该反应中被氧化的元素是_______ 。 若将该反应设计成一原电池,则_______ 极 (填电极名称)附近溶液出现紫红色。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______。
(6)已知如下热化学方程式:
Ca(s)+Cl2(g)→CaCl2(s)+ 795kJ
Sr(s)+Cl2(g)→SrCl2(s) + 828kJ
Ba(s)+ Cl2(g) → BaCl2(s) + 860kJ
则①CaCl2、②SrCl2、③BaCl2三种氯化物的稳定性由大到小的排列为_______ (填序号)。从能量的角度解释理由是_______ 。
(1)铅元素位于元素周期表第六周期IVA族,该族中原子序数最小的元素的原子有
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是
(3)配平下列化学方程式,把系数以及相关物质填写在空格上,并标出电子转移的方向和数目
_______PbO2+_______MnSO4+______HNO3→_______HMnO4+______Pb(NO3)2+_______PbSO4↓+_______
(4)把上述反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol·L-1,则反应中转移的电子数为
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______。
| A.PbO2+4HCl →PbCl4+2H2O | B.PbO2+4HCl →PbCl2+ Cl2↑+2H2O |
| C.PbO2+2HCl+2H+→PbCl2+2H2O | D.PbO2+4HCl→PbCl2+2OH- |
Ca(s)+Cl2(g)→CaCl2(s)+ 795kJ
Sr(s)+Cl2(g)→SrCl2(s) + 828kJ
Ba(s)+ Cl2(g) → BaCl2(s) + 860kJ
则①CaCl2、②SrCl2、③BaCl2三种氯化物的稳定性由大到小的排列为
您最近一年使用:0次
名校
解题方法
9 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位置,结构和性质的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
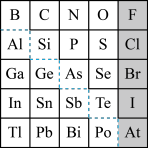
(l)Ge 的最高价氧化物对应水化物的化学式为_____ ,P、S、Cl元素对应的简单离子的还原性由强到弱的顺序为_____ 。(写离子符号)
(2)根据元素周期律,推断:
①阴影部分元素最高价氧化物对应水化物的酸性最强的是_____ 。(写化学式)
②H3AsO4、H2SeO4的酸性强弱:H3AsO4(填“> ”“< ”或“=” )_____ H2SeO4。
③镓的氯化物与氨水反应的化学方程式为_____
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。:如2A1+4BaO 3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是
3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是____________
a.高温时Al 的活泼性大于Ba b.高温有利于BaO 分解
c.高温时BaO• A12O3比A12O3稳定 d.Ba的沸点比Al 的低
(4)用铝热法还原下列氧化物,制得金属各l mol,消耗铝最少的是________ 。
a.MnO2 b.WO3 c.Cr2O3 d.Co3O4

(l)Ge 的最高价氧化物对应水化物的化学式为
(2)根据元素周期律,推断:
①阴影部分元素最高价氧化物对应水化物的酸性最强的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4(填“> ”“< ”或“=” )
③镓的氯化物与氨水反应的化学方程式为
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。:如2A1+4BaO
 3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是
3Ba↑ +BaO •A12O3,利用上述方法可制取Ba的主要原因是a.高温时Al 的活泼性大于Ba b.高温有利于BaO 分解
c.高温时BaO• A12O3比A12O3稳定 d.Ba的沸点比Al 的低
(4)用铝热法还原下列氧化物,制得金属各l mol,消耗铝最少的是
a.MnO2 b.WO3 c.Cr2O3 d.Co3O4
您最近一年使用:0次
10 . 碳及其化合物在生产、生活中有广泛的用途。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为____________ ,R的电子式为______________ ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为_____________ ,除去粗产品中少量钠的试剂为______________ ;
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为____________________ ,硅酸盐的物质的量浓度为____________ 。
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
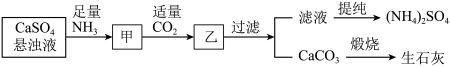
(1)向甲中通入过量CO2__________ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_________________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为___________________________ ;
②请分析CaSO4转化为CaCO3的原理:___________________________ 。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次



