1 . 碳及其化合物在生产、生活中有广泛的用途。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为____________ ,R的电子式为______________ ;
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为_____________ ,除去粗产品中少量钠的试剂为______________ ;
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为____________________ ,硅酸盐的物质的量浓度为____________ 。
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:
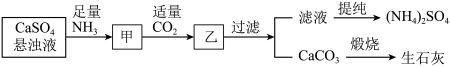
(1)向甲中通入过量CO2__________ (填“有”或“不”)利于CaCO3和(NH4)2SO4的生成,原因是_________________ 。
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是____________ (填含量最多的一种)。
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为___________________________ ;
②请分析CaSO4转化为CaCO3的原理:___________________________ 。
I.金刚砂SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与同周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,则Q元素在周期表中的位置为
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收CCl4的实验操作名称为
(3)碳还原制取SiC,其粗产品中杂质为Si和SiO2。先将20.0g SiC粗产品加入到过量NaOH溶液中充分反应,收集到0.1 mol氢气,过滤SiC固体11.4g,滤液稀释到1L。Si与NaOH溶液反应的离子方程式为
II.工业上向氨化的CaSO4悬浊液中通入适量CO2,可制取(NH4)2SO4,其流程如图所示。已知CaSO4的KSP=9.1×10-4,CaCO3的KSP=2.8×10-4。请回答:

(1)向甲中通入过量CO2
(2)直接蒸干滤液得到的(NH4)2SO4主要含有的杂质是
(3)锅炉水垢中含有的CaSO4,可先用Na2CO3溶液浸泡,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为
②请分析CaSO4转化为CaCO3的原理:
您最近一年使用:0次
名校
2 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
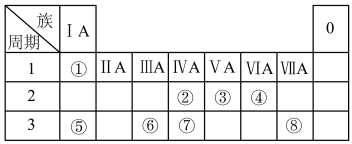
(1)⑦号元素的原子结构示意图为___________________________ 。
(2)②、③、⑤的单质熔点由大到小的顺序为(填化学式)________ 。
(3)①和②、①和③、①和⑦形成的化合物稳定性由强到弱的顺序是(填化学式)__________________________________________________ 。
(4)④、⑤可形成既含离子键又含共价键的化合物,请写出其电子式:________ 。
(5)由①和②组成的最简单的化合物的键角是________ 。
(6)⑤、⑥两种元素形成的最高价氧化物的水化物之间相互反应的离子方程式为__________________________________________________ 。

(1)⑦号元素的原子结构示意图为
(2)②、③、⑤的单质熔点由大到小的顺序为(填化学式)
(3)①和②、①和③、①和⑦形成的化合物稳定性由强到弱的顺序是(填化学式)
(4)④、⑤可形成既含离子键又含共价键的化合物,请写出其电子式:
(5)由①和②组成的最简单的化合物的键角是
(6)⑤、⑥两种元素形成的最高价氧化物的水化物之间相互反应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 现有a~i 9种短周期元素,它们在同期表中的位置如下,请据此回答下列问题:(请用具体的元素符号及化学用语作答)
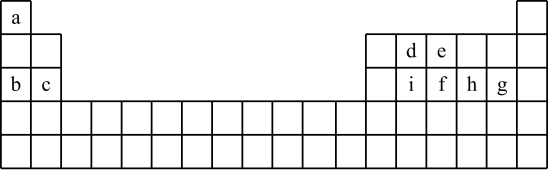
(1)a~i元素中,金属性最强的是________ ,最高价氧化物对应水化物中,酸性最强的物质是___________ 。g所在族的元素形成的氢化物中沸点最低的是____________________ 。
(2)比较b、e、g简单离子半径的大小___________________ (用离子符号作答)。
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式__________________ 、___________________ 。
(4)用一个化学反应方程式表示d的非金属性强于i_______________________________ 。
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是______ (填序号)。
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号_________ ;镓(Ga)与As同周期,最外层有3个电子,Ga与As可以形成一种新型化合物半导体材料,其性能更优越。这种新型化合物化学式为____________________ 。
(6)c与a形成的化合物的电子式为___________ ,用电子式表示a与h形成a2h的过程__________________________________________ 。
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式_________________________________ 。

(1)a~i元素中,金属性最强的是
(2)比较b、e、g简单离子半径的大小
(3)写出由a~i 9种元素中的某些元素形成,且所有原子都满足最外层为8电子结构的任意两种化合物的化学式
(4)用一个化学反应方程式表示d的非金属性强于i
(5)由于在周期表中位置相近的元素性质相近,启发了人们在周期表中的一定区域内寻找新的物质。人们在周期表里金属和非金属的交界处找到了半导体材料。
①下列单质中,不能做半导体材料的物质是
A.Si B.Ge C.S
②砷(As)是e的同族元素,上比e多2个电子层,砷的一种核素含有42个中子,该核素的符号
(6)c与a形成的化合物的电子式为
(7)根据周期表对角线法则,金属Be和Al单质及化合物性质相似。试写出Be和氢氧化钠溶液反应的离子方程式
您最近一年使用:0次
名校
4 . (1)下图所示元素周期表中全部是金属元素的区域为___________
A.A B.B C.C D.D
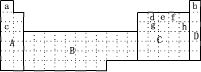
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。______________
②甲、乙两元素相比较,金属性较强的是_________ (填名称),可以验证该结论的实验是_______ 。
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:______ ,比较C、B、D结合氢离子的能力由强到弱的顺序为_________________ (用化学式表示)。
(4)上表中c、h元素形成的简单离子半径之比________ 1(填〉或〈或 =)。
A.A B.B C.C D.D

(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是
A.将在空气中放置很久的这两种元素的块状单质分别放入热水中
B.将这两元素的单质粉末分别和同浓度的盐酸反应
C.将这两元素的单质粉末分别和热水作用,并滴入酚酞
D.比较这两种元素的气态氢化物的稳定性
(3)上表中所列某些元素间能形成等电子的A、B、C、D、E五种微粒,A与C组成元素相同,B、E、D组成元素相同,它们间能发生如下反应:A+B=C+D,E+B=2D,则写出B的电子式:
(4)上表中c、h元素形成的简单离子半径之比
您最近一年使用:0次
2018-04-13更新
|
505次组卷
|
2卷引用:黑龙江省双鸭山市第一中学2017-2018学年高一4月月考化学试题1
名校
5 . A、B、C、D、E代表5种元素.请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为_______ ;
(2)B元素的负一价离子的电子层结构都与氩相同,B的原子结构示意图为____ ;
(3)C元素是第三周期中无未成对电子的主族元素,它的轨道排布式为___________ ;
(4)D元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为______ 。
(5)E原子共有3个价电子,其中一个价电子位于第三能层d轨道,指出该元素在周期
表中所处的周期数和族序数:____________________ .
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为
(2)B元素的负一价离子的电子层结构都与氩相同,B的原子结构示意图为
(3)C元素是第三周期中无未成对电子的主族元素,它的轨道排布式为
(4)D元素的正三价离子的3d能级为半充满,其基态原子的电子排布式为
(5)E原子共有3个价电子,其中一个价电子位于第三能层d轨道,指出该元素在周期
表中所处的周期数和族序数:
您最近一年使用:0次
2017-11-02更新
|
541次组卷
|
2卷引用:福建省福州市八县(市)协作校2016-2017学年高二下学期期中考试化学试题
名校
6 . 硒的原子序数为34,是硫的同主族元素,硒的单质及其化合物用途非常广泛。
(1)硒位于周期表第___ ,周期___ 族。Se2Cl2常用作分析试剂,其电子式为_____ 。
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是_____ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___ 。用氨水中和亚硒酸后得到亚硒酸铵,再向( NH4)2SeO3溶液中加入Na2S2O3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为______ 。
(1)硒位于周期表第
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为
您最近一年使用:0次
2017-10-30更新
|
892次组卷
|
2卷引用:江西省百所名校2018届高三第一次联合考试化学试题
名校
7 . 短周期元素 a~g 在表中的位置如右表,请回答下列问题:
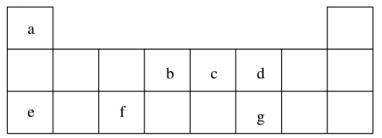
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________ ;b、c两元素非金属性较强的是(写元素符号)_________ ,写出能证明这一结论的一个化学方程式_____________ 。
(2)下列有关说法正确的是( )
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)_______ (填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________ 。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________ 。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________ 。

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)
(2)下列有关说法正确的是
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)
②R常用作净水剂,其原理为(用离子方程式表示)
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:
您最近一年使用:0次
2017-10-21更新
|
707次组卷
|
3卷引用:四川省成都市第七中学2017-2018学年高二上学期第一次月考化学试题
名校
解题方法
8 . 根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________ 。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________ 。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________ 。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________ , Z的电子式为_____________________ 。
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________ 。此过程不用瓷坩埚的原因是_________________________ 。
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为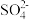 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式_________________ 。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为
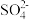 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式
您最近一年使用:0次
9 . 下图是元素周期表的一部分。
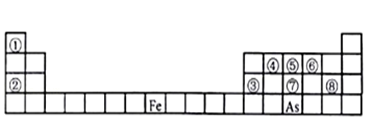
Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为_______ ,由①、⑤两元素构成的10电子化合物的形成过程为_______ 。
(2)⑦、⑧的最高价含氧酸的酸性较弱的是_______ 。(化学式表示)
(3)As在元素周期表中位置为__ ;氢化物的沸点:NH3 _______ AsH3(填“>”或“<”)
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______ ,当消耗75g还原剂时,电子转移了__ mol。
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。
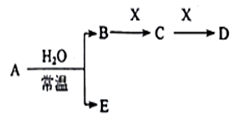
(1)A与水反应的化学方程式为_______ 。
(2)工业上常用CO热还原法冶炼X,写出其化学方程式_______ 。
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式_______ 。
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为_______ ;
(2)B的化学式为_______ 。

Ⅰ、用化学用语回答下列问题:
(1)由②、⑥两元素形成的强氧化性物质的电子式为
(2)⑦、⑧的最高价含氧酸的酸性较弱的是
(3)As在元素周期表中位置为
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为
Ⅱ、A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物。已知A、B、C、D、E、X存在如下图所示转化关系(部分生成物和反应条件略去),若常温下A为红棕色气体,B为强酸,X为常见金属单质。

(1)A与水反应的化学方程式为
(2)工业上常用CO热还原法冶炼X,写出其化学方程式
(3)某温度下(>100℃)若m克X与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式
Ⅲ、由①、⑤、⑥、S和Fe五种元素组成的相对分子质量为392的化合物B,B中含有结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
(1)由实验a、b推知B溶液中含有的离子为
(2)B的化学式为
您最近一年使用:0次
10 . (1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):
请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________ ,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________ 。
②上述配离子中含有的化学键类型有:__________________ 。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______ ;其中铜离子的配位数是_______ 。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____ 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____ ;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______ 和______ (填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________ 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________ (写2种)。

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是
②上述配离子中含有的化学键类型有:
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为
②Fe元素位于周期表的
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为
③根据VSEPR理论预测ED4-离子的空间构型为
您最近一年使用:0次



