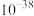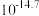解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。
2.25℃时,相关物质的 如下:
如下:
回答下列问题:
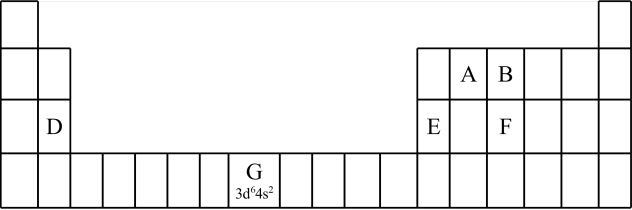
(1)Ni属于元素周期表的________ 区。
(2)混合气在“氧化”中,产生 ,其中S的化合价为
,其中S的化合价为________ 。
(3)“滤渣”的成分之一是软锰矿的主要成分,由 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为________ ;其可用于实验室制取氯气,该反应的离子方程式为________ 。
(4)若使 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于________ 。
(5)上述表格中a________ b(填“大于”、“小于”或“无法确定”)。
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是________ 。
(7)滤液2中含有的金属阳离子是________ 。
 、
、 、
、 、
、 、
、 、
、 )实现镍、钴、镁元素的回收。
)实现镍、钴、镁元素的回收。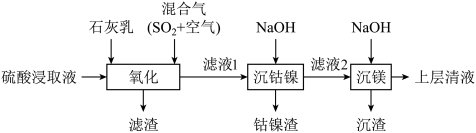
 )的电离第一步完全,第二步微弱。
)的电离第一步完全,第二步微弱。2.25℃时,相关物质的
 如下:
如下:物质 |
|
|
|
|
|
|
| a | b |
(1)Ni属于元素周期表的
(2)混合气在“氧化”中,产生
 ,其中S的化合价为
,其中S的化合价为(3)“滤渣”的成分之一是软锰矿的主要成分,由
 氧化产生,该反应的离子方程式为
氧化产生,该反应的离子方程式为(4)若使
 沉淀完全(浓度
沉淀完全(浓度 ),需调节pH不低于
),需调节pH不低于(5)上述表格中a
(6)“沉钴镍”后需将钴镍渣洗涤干净,实验室检验其是否洗净的方法是
(7)滤液2中含有的金属阳离子是
您最近一年使用:0次
名校
2 . 钨(W)常用于制造白炽灯、碘钨灯等。工业上以黑钨矿(主要成分是 、
、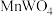 ,含少量
,含少量 、
、 )为原料冶炼钨的流程如图所示。
)为原料冶炼钨的流程如图所示。
请回答下列问题:
(1)基态 核外电子占据能量最高的能级符号是
核外电子占据能量最高的能级符号是__________ ;Mn位于元素周期表__________ 区。
(2)“粉碎”的目的是__________ ;从“浸取”得到的浸渣中分离出 的操作方法是
的操作方法是__________ 、过滤、洗涤、干燥。
(3)根据“转化”,判断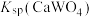
__________ 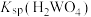 (填“>”或“<”)。
(填“>”或“<”)。
(4)“灼烧”中盛装固体的仪器是__________ (填名称);发生反应的化学方程式为______________________________ 。
(5)碳化钨是一种耐磨、耐高温、高硬度材料。碳化钨晶胞如图所示。已知:晶胞底边长为apm,高为bpm, 为阿伏加德罗常数的值。碳化钨晶体密度为
为阿伏加德罗常数的值。碳化钨晶体密度为__________  (列出计算式即可)。
(列出计算式即可)。
 、
、 ,含少量
,含少量 、
、 )为原料冶炼钨的流程如图所示。
)为原料冶炼钨的流程如图所示。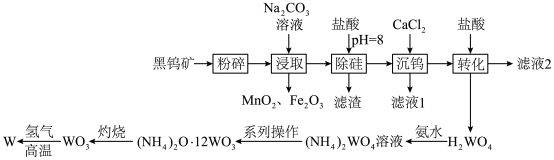
请回答下列问题:
(1)基态
 核外电子占据能量最高的能级符号是
核外电子占据能量最高的能级符号是(2)“粉碎”的目的是
 的操作方法是
的操作方法是(3)根据“转化”,判断
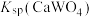
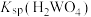 (填“>”或“<”)。
(填“>”或“<”)。(4)“灼烧”中盛装固体的仪器是
(5)碳化钨是一种耐磨、耐高温、高硬度材料。碳化钨晶胞如图所示。已知:晶胞底边长为apm,高为bpm,
 为阿伏加德罗常数的值。碳化钨晶体密度为
为阿伏加德罗常数的值。碳化钨晶体密度为 (列出计算式即可)。
(列出计算式即可)。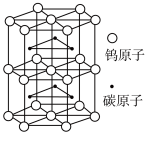
您最近一年使用:0次
2024-05-11更新
|
63次组卷
|
2卷引用:江西省部分学校2023-2024学年高三下学期二轮复习联考验收化学试卷
名校
3 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号 、115号
、115号 、117号
、117号 、118号
、118号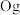 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
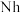 、115号
、115号 、117号
、117号 、118号
、118号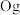 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
46次组卷
|
2卷引用:安徽省淮南第二中学2023-2024学年高二下学期期中测试化学试题
名校
解题方法
4 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
名校
解题方法
5 . 近期科研人员研究发现,四苯基膦阳离子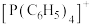 (结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。
(结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。_____ ,基态P原子电子占据的最高能级符号为_____ 。
(2)氯化四苯基膦可通过 和
和 反应得到。
反应得到。 是
是_____ (填“极性”或“非极性”)分子, 分子空间构型为
分子空间构型为_____ 。
(3)氯化四苯基膦( )在水中和有机溶剂中都有一定溶解性,其原因是
)在水中和有机溶剂中都有一定溶解性,其原因是_____ 。这一性质可使其用作不相溶的有机溶液和水溶液之间反应的催化剂。
(4)基态 原子的价电子排布式为
原子的价电子排布式为 ,
, 在元素周期表中的位置是
在元素周期表中的位置是_____ 。
(5)在上述晶体材料中,氯化镉阴离子以单体 或
或 形式存在,
形式存在,
_____ 。
(6)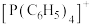 与
与 形成的杂化晶体材料中,存在的化学键有
形成的杂化晶体材料中,存在的化学键有_____ 。
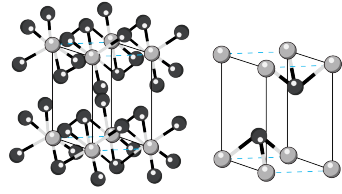
(7)碘化镉晶胞示意图如下图所示。碘原子和镉原子分层排布,“一层镉、一层碘、一层碘”地相间。_____ 。
②镉原子的配位数是_____ 。
③碘化镉晶体很容易解离成片状,原因是_____ 。
(8)氧化镉晶体如下所示。已知晶胞边长为anm,阿伏加德罗常数为 ,该晶体密度为
,该晶体密度为_____  。(列计算式表达)
。(列计算式表达)
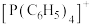 (结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。
(结构如下)可与卤化镉(Cd)阴离子簇(卤素为Cl或Br)通过自组装形成多种杂化晶体材料,具有优异的发光特性。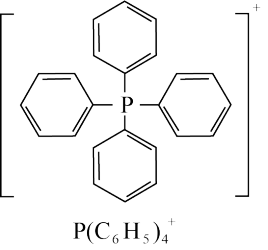
(2)氯化四苯基膦可通过
 和
和 反应得到。
反应得到。 是
是 分子空间构型为
分子空间构型为(3)氯化四苯基膦(
 )在水中和有机溶剂中都有一定溶解性,其原因是
)在水中和有机溶剂中都有一定溶解性,其原因是(4)基态
 原子的价电子排布式为
原子的价电子排布式为 ,
, 在元素周期表中的位置是
在元素周期表中的位置是(5)在上述晶体材料中,氯化镉阴离子以单体
 或
或 形式存在,
形式存在,
(6)
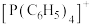 与
与 形成的杂化晶体材料中,存在的化学键有
形成的杂化晶体材料中,存在的化学键有(7)碘化镉晶胞示意图如下图所示。碘原子和镉原子分层排布,“一层镉、一层碘、一层碘”地相间。
②镉原子的配位数是
③碘化镉晶体很容易解离成片状,原因是
(8)氧化镉晶体如下所示。已知晶胞边长为anm,阿伏加德罗常数为
 ,该晶体密度为
,该晶体密度为 。(列计算式表达)
。(列计算式表达)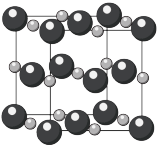
您最近一年使用:0次
解题方法
6 . 尿素还原法合成溴化锂,设备简单、产品质量好、无有毒气体排放、生产成本低。下图是制备无水溴化锂的工艺路线:
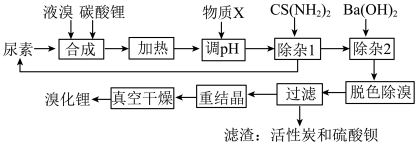
回答下列问题:
(1)Br位于周期表第________ 周期________ 族。
(2)常用焰色试验鉴别碳酸锂,火焰呈现________ 色。
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因________ 。
(4)合成溴化锂的主要化学方程式________ 。
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为________ 。
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是________ 。
(7)重结晶的操作为________ 。

温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
碳酸锂溶解度(g) | 1.51 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
(1)Br位于周期表第
(2)常用焰色试验鉴别碳酸锂,火焰呈现
(3)在溶解槽中,边搅拌边分次少量地将细粉末状的碳酸锂溶解于冷的溴水中至饱和为止,选用“冷”的溴水溶解碳酸锂的主要原因
(4)合成溴化锂的主要化学方程式
(5)合成时加入液溴会使pH降低,实际生产时需维持pH为4-5,为调节pH为4-5,从生产实际出发物质X最佳为
(6)加热体系的温度超过80℃会发生副反应:
3Br2+3H2O=5HBr+HBrO3
3HBrO=2HBr+HBrO3
Li2CO3+2HBrO3=2LiBrO3+H2O+CO2↑
还原溴酸锂需要选用硫脲,“除杂1”所发生的化学方程式是
(7)重结晶的操作为
您最近一年使用:0次
2024-04-02更新
|
329次组卷
|
2卷引用:2024届湖北省十一校高三下学期第二次联考化学试卷
名校
解题方法
7 . 氧族元素Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
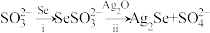
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表___________ 区。
②SeSO 的空间结构是
的空间结构是___________ 。
③过程ii中SeSO 一定断裂的化学键是
一定断裂的化学键是___________ 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由___________ 。
②NH 中H—N—H键角
中H—N—H键角___________ (填“>”或“<”)NH3中H—N—H键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为___________ g·cm-3。(1nm=10-7cm)
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。
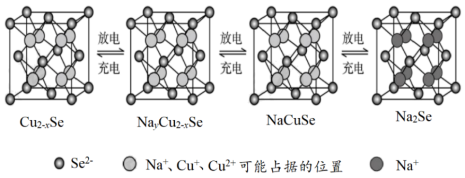
每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为___________ 。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO
 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下: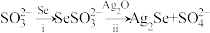
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表
②SeSO
 的空间结构是
的空间结构是③过程ii中SeSO
 一定断裂的化学键是
一定断裂的化学键是(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由
②NH
 中H—N—H键角
中H—N—H键角③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。

每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为
您最近一年使用:0次
2024-02-23更新
|
425次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题
名校
8 . 如表为元素周期表的一部分,用化学用语回答下列问题:
(1)⑧的原子结构示意图为________ 。
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是________ (填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________ (填化学式)。
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为________ 。②④两种元素形成的原子数目比为1:2的共价化合物的结构式为________ 。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为________ 。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的分子式为___________ ;⑦的最高价氧化物对应水化物的分子式为___________ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:___________ 、___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
(5)半径大小比较:③___________ ④;金属性强弱比较:⑤___________ ⑥(填“>”、“<”或“=”)。
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 | B.气态氢化物比 稳定 稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
(5)半径大小比较:③
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
解题方法
10 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,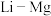 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
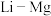 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次