解题方法
1 . 为纪念DmitriMendeleev(德米特里·门德列夫)发明的元素周期表诞生150周年。联合国大会宣布2019年是“国际化学元素周期表年”。以下是元素周期表的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是___________ 。
(2)最高价氧化物的水化物中酸性最强的是___________ 。
(3)元素B原子核外有___________ 种能量不同的电子,基态C原子最高能级电子云形状是___________ 。
(4)比较元素的金属性:B___________ C(填“>”或“<”),从原子结构的角度说明理由___________ 。
(5)A分别与E、G、H形成的化合物中,最稳定的是___________
(6)检验B元素的方法是___________ ,请用原子结构的知识解释产生此现象的原因:___________ 。
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有___________ (填“极性”或“非极性”)共价键,若将其投入硫酸亚铁溶液中,预测主要的反应现象是___________ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 1 | A | ||||||||
| 2 | D | E | G | ||||||
| 3 | B | C | J | H | I |
(2)最高价氧化物的水化物中酸性最强的是
(3)元素B原子核外有
(4)比较元素的金属性:B
(5)A分别与E、G、H形成的化合物中,最稳定的是
(6)检验B元素的方法是
(7)元素B的单质在空气中点燃生成X,X中的化学键除离子键,还有
您最近一年使用:0次
名校
2 . 如表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
(1)同位素在生活生产和科学研究中有着重要的用途。例如,考古时利用___________ (填核素符号)测定一些文物的年代。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是___________ ,碱性最强的化合物的化学式是___________ 。
(3)写出⑤和⑦的最高价氧化物的水化物反应的离子方程式___________ 。
(4)元素①与⑧形成的化合物属于___________ (填“共价”或“离子”)化合物。
(5)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是___________ 。
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤和⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤和⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是
(3)写出⑤和⑦的最高价氧化物的水化物反应的离子方程式
(4)元素①与⑧形成的化合物属于
(5)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是
A.将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B.比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C.将⑤和⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D.将⑤和⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
您最近一年使用:0次
3 . A、B、C是短周期ⅠA和ⅡA族元素的碳酸正盐,它们的质量分别为mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:___ 。
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式___ 。
(3)A的正确选择有___ 种,其化学式为:___ 。
已知:。mA=mB+mC,nA(HCl)=nB(HCl)+nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式
(3)A的正确选择有
您最近一年使用:0次
18-19高一下·江西南昌·期中
解题方法
4 . 下图是周期表的一部分,回答下列问题:
(1)A的原子结构示意图是_________________ ;
(2)E在周期表的位置为_________________________ ;与E同族的下一周期元素的原子序数为___________ ;
(3)表中元素形成气态氢化物最稳定的是___________ (填化学式,下同),最高价氧化物对应水化物酸性最强的是________________ ;
(4)下列不能用来对比C和D金属性强弱的是_________
a.C单质的熔点比D低
b.C的阳离子的氧化性弱于D的阳离子的氧化性
c.C单质与水反应比D单质与水反应剧烈
d.C最高价氧化物对应水化物的碱性比D强
(5)元素A与H分别与H形成的18电子分子Q和W(常用作火箭燃料)可以发生氧化还原反应,生成H单质和A的另一种氢化物。请写出该反应的方程式:______________________ 。
| H | A | B | ||||||
| C | D | E | F | G | ||||
(2)E在周期表的位置为
(3)表中元素形成气态氢化物最稳定的是
(4)下列不能用来对比C和D金属性强弱的是
a.C单质的熔点比D低
b.C的阳离子的氧化性弱于D的阳离子的氧化性
c.C单质与水反应比D单质与水反应剧烈
d.C最高价氧化物对应水化物的碱性比D强
(5)元素A与H分别与H形成的18电子分子Q和W(常用作火箭燃料)可以发生氧化还原反应,生成H单质和A的另一种氢化物。请写出该反应的方程式:
您最近一年使用:0次
解题方法
5 . 如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
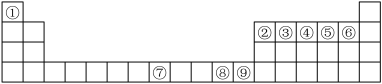
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________ 区。
(2)④、⑥两元素形成的化合物的立体构型为________ ,其中心原子的杂化轨道类型为________ 。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________ 。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________ 。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____ ,写出与化合物A互为等电子体的一种阳离子______ (填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______ (填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________ 晶体(填晶体类型),化合物中⑦的化合价为:_______ 。根据等电子体理论,该化合物的配体的结构式为:_______ ,CaC2中,阴离子的电子式为: ____________________ 。

(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的
(2)④、⑥两元素形成的化合物的立体构型为
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于
您最近一年使用:0次
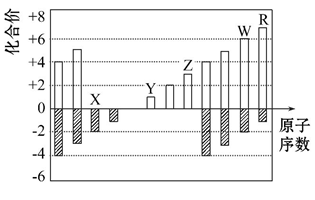
6 . 如图是部分短周期元素化合价与原子序数的关系图
请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为____________
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =____________ 。

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为
(4)某阴离子 Wa2-(a 为2 − 6之间的数字)在碱性溶液中被 BrO3‾离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH ‾离子的物质的量之比为 2:3,则 a =
您最近一年使用:0次
18-19高三·浙江·期中
7 . 下图是元素周期表的一部分。
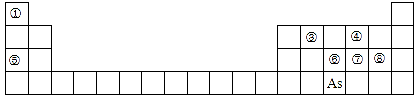
Ⅰ.(1)④、⑤、⑧的离子半径由大到小的顺序为_________ (用离子符号表示)。
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是_______ 。(用化学式表示)
(3) 由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂,
由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂, 可与
可与 的水溶液反应,产物有
的水溶液反应,产物有 的最高价含氧酸,该反应的化学方程式为
的最高价含氧酸,该反应的化学方程式为_______________ 。
Ⅱ.以下框图中的物质均为中学中常见的化合物或单质(部分产物略去),已知化合物 为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
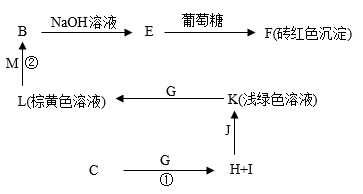
(1)化合物 的电子式为
的电子式为______________ , 的化学式为
的化学式为____________ 。
(2)写出反应①和反应②的离子方程式
①________________________________________ 。
②________________________________________ 。

Ⅰ.(1)④、⑤、⑧的离子半径由大到小的顺序为
(2)③、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是
(3)
 由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂,
由④⑤⑧三种元素组成,它的水溶液是生活中常见的消毒剂, 可与
可与 的水溶液反应,产物有
的水溶液反应,产物有 的最高价含氧酸,该反应的化学方程式为
的最高价含氧酸,该反应的化学方程式为Ⅱ.以下框图中的物质均为中学中常见的化合物或单质(部分产物略去),已知化合物
 为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
为由以上①④两种元素组成的人类生命活动不可缺少的常见液态物质,试回答
(1)化合物
 的电子式为
的电子式为 的化学式为
的化学式为(2)写出反应①和反应②的离子方程式
①
②
您最近一年使用:0次
名校
8 . 根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
(1)表中元素,化学性质最不活泼的是_____ ,只有负价而无正价的是_____ ,氧化性最强的单质是____ ;
(2)最高价氧化物的水化物碱性最强的是_____ ,酸性最强的是_____ ,呈两性的是_____ ;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____ ;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____ ;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______ 可以验证该结论的实验是_ 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是
(2)最高价氧化物的水化物碱性最强的是
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
2019-10-25更新
|
118次组卷
|
2卷引用:上海外国语大学附属外国语学校2017-2018学年高二12月月考化学试题
解题方法
9 . W、X、Y、Z为原子序数依次递增的短周期主族元素,W的单质是同条件下密度最小的气体,X、Y、Z为同一周期紧邻元素,M、R为同一主族的元素,M的单质常温为液态,R的单质常温为固态,且易升华。回答下列问题:
(1)写出下列元素的名称:W___ ;M____ 。
(2)若X为形成化合物种类最多的元素,XZ(YW2)2为一种有机物,是目前使用量较大的化学肥料。XZ(YW2)2在碱性条件下能被MZ−氧化成单质Q(空气中的主要成分之一),X以酸根的形式存在。
①写出Q的化学式:___ ;X、Y、Z的简单氢化物的沸点由高到低的顺序为__ (写化学式)。
②上述反应的离子方程式为___ 。
(3)若Z为本周期中半径最小的元素,其最高价氧化物对应的水化物为强酸。
①请判断R2+ZO3-→RO3-+Z2是否能发生,__ (填“能”或“不能”)发生,其原因是____ 。
②请写出R2与含YO32-溶液反应的离子方程式为____ 。
(1)写出下列元素的名称:W
(2)若X为形成化合物种类最多的元素,XZ(YW2)2为一种有机物,是目前使用量较大的化学肥料。XZ(YW2)2在碱性条件下能被MZ−氧化成单质Q(空气中的主要成分之一),X以酸根的形式存在。
①写出Q的化学式:
②上述反应的离子方程式为
(3)若Z为本周期中半径最小的元素,其最高价氧化物对应的水化物为强酸。
①请判断R2+ZO3-→RO3-+Z2是否能发生,
②请写出R2与含YO32-溶液反应的离子方程式为
您最近一年使用:0次
2019-09-26更新
|
387次组卷
|
2卷引用:学科网2019年高三11月大联考(样卷)化学试题
13-14高一·全国·课时练习
名校
解题方法
10 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是________ 。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________ 。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________ 。
A.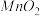 B.
B.
C. D.
D.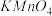
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
A.
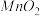 B.
B.
C.
 D.
D.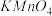
您最近一年使用:0次
2019-08-20更新
|
165次组卷
|
7卷引用:2014年高一化学人教版必修2 模块水平检测1练习卷
(已下线)2014年高一化学人教版必修2 模块水平检测1练习卷(已下线)2013-2014山东省淄博市高一下学期期末考试化学试卷2015-2016学年河北省秦皇岛市卢龙县高一下学期期中考试化学试卷2015-2016学年山西省长治一中高一平行班下期中化学试卷云南省峨山彝族自治县第一中学2017-2018学年高二上学期期末市统测模拟考化学试题百所名校联考-必修二模块综合检测山东省泰安市新泰市第二中学2019-2020学年高一下学期期中考试化学试题



