名校
解题方法
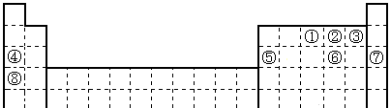
1 . 元素①~⑧在元素周期表中的位置如下,回答有关问题:
(1)某元素是①~⑧外的元素,其最外层电子数是次外层电子数的 ,在地壳中含量仅次于氧元素,则该元素在周期表的位置
,在地壳中含量仅次于氧元素,则该元素在周期表的位置_______________ ;
(2)元素①~⑧化学性质最稳定的元素是________ (填数字), 写出该元素含有22个中子的核素的化学符号________
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为_______________ (用化学式表示,下同),②③⑥元素氢化物的稳定性最强的是________ (填化学式)。
(4)比较④_________ ⑧的金属性(填“>”或“<”),能说明这一结论的依据有________
A.单质的熔点大小 B.最高价氧化物水化物的碱性强弱
C.单质的密度大小 D.单质与水反应的剧烈程度
(5)能体现②⑥元素非金属性强弱的化学方程式_______________________________ 。
(1)某元素是①~⑧外的元素,其最外层电子数是次外层电子数的
 ,在地壳中含量仅次于氧元素,则该元素在周期表的位置
,在地壳中含量仅次于氧元素,则该元素在周期表的位置(2)元素①~⑧化学性质最稳定的元素是
(3)在②、③、④、⑤四种元素中,其离子半径按由大到小的排列顺序为
(4)比较④
A.单质的熔点大小 B.最高价氧化物水化物的碱性强弱
C.单质的密度大小 D.单质与水反应的剧烈程度
(5)能体现②⑥元素非金属性强弱的化学方程式
您最近一年使用:0次
解题方法
2 . 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期。自然界存在多种A的化合物,B原子核外电子由6种不同的运动状态,B与C可形成正四面体形分子,D的M能层没有空轨道且只有2个未成对电子。请回答下列问题:
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为________ 。
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有________ 个六元环;图2位在元素周期表中与B相邻的元素位置关系,B、G形成的晶胞结构如图3所示(其中“●”为B元素原子,“〇”为G元素原子),图中“●”点构成的堆积方式与图4中_____ (填序号)所表示的堆积方式相同;图3的结构中,设晶胞边长为a cm,B原子直径为bcm,G原子直径为c cm,则该晶胞的空间利用率为_______ (用含a、b、c的式子表示)。

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式_____ (用化学式表示)。
(4)元素C的含氧酸中,酸性最强的是_________ (写化学式),该酸根离子的立体构型为________ 。
(5)基态D原子的核外电子排布式为[Ar]_______ ;D形成的配合物D(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=______ ;由D一铝合金为原料可制得一种历史悠久、应用广泛的催化剂,其催化的i实例为: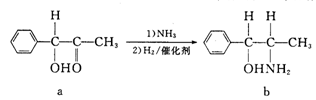 化合物b中进行sp3杂化的原子有
化合物b中进行sp3杂化的原子有__________ (填元素符号)。
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式
(4)元素C的含氧酸中,酸性最强的是
(5)基态D原子的核外电子排布式为[Ar]
 化合物b中进行sp3杂化的原子有
化合物b中进行sp3杂化的原子有
您最近一年使用:0次
名校
解题方法
3 . A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)元素名称:A___ 、B___ 、C___ 、D___
(2)D元素的最高价氧化物的水化物是(化学式)__________ ,A、B两元素形成化合物属 _______ (选填“离子”或“共价”)化合物。
(3)写出A、B的化合物与E反应的化学方程式:____________________ 。
(1)元素名称:A
(2)D元素的最高价氧化物的水化物是(化学式)
(3)写出A、B的化合物与E反应的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 下图是元素周期表的一部分,表中列出了①〜⑨种元素的位置,请根据要求回答问题。
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为________________ 。
(2)②与④形成的化合物的电子式可表示为_________________________________________ 。
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是____________________ (填化学式)。
(4)写出⑤与氢氧化钠溶液反应的化学方程式:_____________________________________ 。
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(2)②与④形成的化合物的电子式可表示为
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是
(4)写出⑤与氢氧化钠溶液反应的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素是______ 。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______ (用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________ 。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___ 。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____ 。(填化学式)
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是
(2)②③④三种元素的原子半径从大到小的顺序是
(3)用电子式表示③与⑦形成化合物的过程
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的
(5)在⑦与⑩的单质中,化学性质较活泼的是
您最近一年使用:0次
2017-04-27更新
|
340次组卷
|
3卷引用:广东省仲元中学2016-2017学年高一下学期期中考试(理)化学试题
名校
解题方法
6 . (1)写出下列具有10个电子的粒子的化学式:原子的原子结构示意图_____________ ,由2个原子组成的分子是_____________ 、阴离子是_____________ 。
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
①写出Y元素的名称_____________________ 。
②写出W元素在周期表中的位置__________________ 。
③写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式________________________ 。
④按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:_____________ ,_____________ ,_____________ ,_____________ 。
(2)X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大。已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8。
①写出Y元素的名称
②写出W元素在周期表中的位置
③写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式
④按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:
您最近一年使用:0次
名校
解题方法
7 . 下表是元素周期表的一部分。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
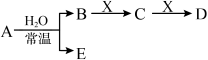
(1)⑧的元素符号是______ 。
(2)⑤与As两种元素中,非金属性较强的是______ (填元素符号)。
(3)用化学符号表示②⑤⑥⑦四种元素的简单离子半径由大到小是______________________ 。
(4)元素③与②的最高价氧化物对应的水化物反应的化学方程式是________ 。
(5)若A为红棕色气体,则A、X、D的化学式分别为________ 、________ 、________ 。

已知A、B、C、D、E、X、Y是由表中给出元素组成的常见单质或化合物,并存在如图所示的转化关系(部分生成物和反应条件已略去):
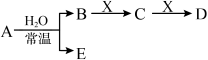
(1)⑧的元素符号是
(2)⑤与As两种元素中,非金属性较强的是
(3)用化学符号表示②⑤⑥⑦四种元素的简单离子半径由大到小是
(4)元素③与②的最高价氧化物对应的水化物反应的化学方程式是
(5)若A为红棕色气体,则A、X、D的化学式分别为
您最近一年使用:0次
名校
解题方法
8 . 过渡元素由于其特殊的核外电子排布而其有特殊的性质,成为化学研究的重点和前沿。
(l)过渡元素处于周期表的____ 区和f 区。
(2)过渡元素能形成简单化合物,还能形成多种配位化合物
① 通常,d轨道全空或全满的过渡金属离子与水分子形成的配合物无颜色,否则有颜色。如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+____ (填“有”或“无”)颜色。
② Ni2+可形成多种配合物,如Ni(CN)42-。写出CN-的电子式____ ,若其中两个CN-被NO2-替换,得到的配合物只有两种结构,则Ni(CN)42-的空间构型是_____ , NO2-的空间构型是_____ ,其中N原子的杂化方式是_____ 。
③ 从结构角度分析并比较CoF2与CoCl2晶体的熔点高低___________ 。
(3)金、铜等金属及合金可用作生产石墨烯的催化剂,下图是一种铜金合金的晶胞示意图:
① 在该铜金合金的晶体中,与Cu原子距离相等且最近的Au原子数为_______ 。
② 原子坐标参数是用来表示晶胞内部各原子相对位置的指标,若A的原子坐标参数为(0,0,0);B的原子坐标参数为(0,1,0) , C的原子坐标参数为(l,0,0)。则D的原子子坐标参数为_________ 。
③ 若Au、Cu原子半径分别为r1和r2,则该晶胞中的原子空间利用率为__________ 。
(l)过渡元素处于周期表的
(2)过渡元素能形成简单化合物,还能形成多种配位化合物
① 通常,d轨道全空或全满的过渡金属离子与水分子形成的配合物无颜色,否则有颜色。如[Co(H2O)6]2+显粉红色,据此判断,[Mn(H2O)6]2+
② Ni2+可形成多种配合物,如Ni(CN)42-。写出CN-的电子式
③ 从结构角度分析并比较CoF2与CoCl2晶体的熔点高低
(3)金、铜等金属及合金可用作生产石墨烯的催化剂,下图是一种铜金合金的晶胞示意图:
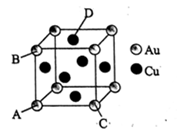
① 在该铜金合金的晶体中,与Cu原子距离相等且最近的Au原子数为
② 原子坐标参数是用来表示晶胞内部各原子相对位置的指标,若A的原子坐标参数为(0,0,0);B的原子坐标参数为(0,1,0) , C的原子坐标参数为(l,0,0)。则D的原子子坐标参数为
③ 若Au、Cu原子半径分别为r1和r2,则该晶胞中的原子空间利用率为
您最近一年使用:0次
2017-04-15更新
|
1007次组卷
|
3卷引用:2017届云南省高三第二次毕业生复习统一检测理综化学试卷
解题方法
9 . 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
回答下列问题:
(1)元素x在周期表中的位置是____ ,其单质可采用电解熔融________ 的方法制备。
(2)气体分子(mn)2的电子式为____ ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为____ 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:____ ,负极:_____ 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式____ 。
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是
(2)气体分子(mn)2的电子式为
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极:
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式
您最近一年使用:0次
解题方法
10 . 下表列出了A﹣R 9种元素在周期表中的位置
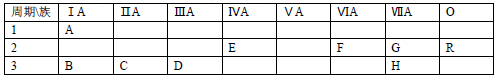
(1)这 9种元素中化学性质最不活泼的是________ (以上均填元素符号)
(2)B、C、D三种元素按原子半径由大到小的顺序排列为________ (用元素符号表示)
(3)F元素简单氢化物的化学式是________ ,H元素跟B元素形成化合物的化学式是______ ,高温灼烧该化合物时,火焰呈________ 色.
(4)G元素和 H元素两者核电荷数之差是________ .

(1)这 9种元素中化学性质最不活泼的是
(2)B、C、D三种元素按原子半径由大到小的顺序排列为
(3)F元素简单氢化物的化学式是
(4)G元素和 H元素两者核电荷数之差是
您最近一年使用:0次



