名校
1 . 如表为元素周期表的一部分,用化学用语回答下列问题:
(1)⑧的原子结构示意图为________ 。
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是________ (填化学式)。
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________ (填化学式)。
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为________ 。②④两种元素形成的原子数目比为1:2的共价化合物的结构式为________ 。
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为________ 。
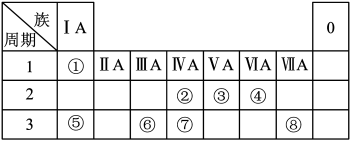
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为
(2)③⑧⑩的最高价氧化物对应的水化物,酸性最强的是
(3)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是
(4)①④⑩三种元素的原子能形成原子数目比为1:1:1的共价化合物,它的电子式为
(5)⑤的最高价氧化物的水化物与⑦的最高价氧化物反应的离子方程式为
您最近一年使用:0次
解题方法
2 . 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是___________ 。
(2)②的最高价氧化物的分子式为___________ ;⑦的最高价氧化物对应水化物的分子式为___________ 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:___________ 、___________ 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
(5)半径大小比较:③___________ ④;金属性强弱比较:⑤___________ ⑥(填“>”、“<”或“=”)。
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为___________ 。

(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②的最高价氧化物的分子式为
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式:
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
| A.最高正化合价为+6 | B.气态氢化物比 稳定 稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |
(5)半径大小比较:③
(6)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第IIIA族元素,则Y的原子序数b与a所有可能的关系式为
您最近一年使用:0次
名校
解题方法
3 . 回答以下关于元素及其化合物的问题。
(1)Na原子核外有________ 种不同能量的电子,其离子最外层电子的轨道表示式________ 。
(2)相同压强下,部分元素氟化物的熔点见下表:
①试解释上表中氟化物熔点差异的原因:___________ 。
② 分子的空间构型为
分子的空间构型为___________ , 中Si—F键间的键角是
中Si—F键间的键角是___________ 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的___________ (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式___________ 。
②根据图B预测,整个周期表中位置最低的元素应位于___________ (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为___________ 。
③图C表示的意义是___________ 。
(4)元素周期表中,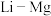 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
(1)Na原子核外有
(2)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 |  |  |  |
| 熔点/℃ | 1266 | 1534 | 183 |
②
 分子的空间构型为
分子的空间构型为 中Si—F键间的键角是
中Si—F键间的键角是(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。

①图A中,数值越大,则该元素的
②根据图B预测,整个周期表中位置最低的元素应位于
③图C表示的意义是
(4)元素周期表中,
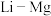 、
、 、
、 处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。
处于对角线关系,其单质与化合物的性质相似。下列说法正确的是___________(选填序号)。A. 易溶于水 易溶于水 | B. |
C. 熔点高 熔点高 | D.晶体硼为分子晶体 |
您最近一年使用:0次
名校
4 . 铁是生产、生活及生命中的重要元素。回答下列问题:
(1)铁在元素周期表中的位置为______ 。
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。
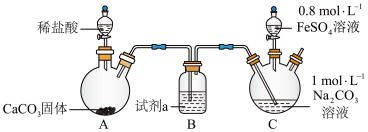
向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为______ 。
②向碳酸钠溶液中通入CO2的目的有______ 、______ 。
③试剂a是______ ,装置C中制取FeCO3的离子方程式为______ 。
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
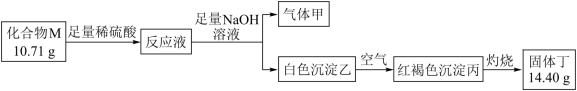
气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式______ 。
(1)铁在元素周期表中的位置为
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。

向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为
②向碳酸钠溶液中通入CO2的目的有
③试剂a是
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式
您最近一年使用:0次
2023-12-14更新
|
482次组卷
|
4卷引用:辽宁省沈阳市第一二0中学2023-2024学年高一上学期第三次质量监测化学试题
5 . Ⅰ.金属单质及其化合物的应用非常广泛。
(1)铁元素在元素周期表中位置为___________ 。
(2)反应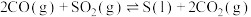
 ,其他条件相同,催化剂不同时,反应相同时间
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择___________ (填“ ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是___________ 。
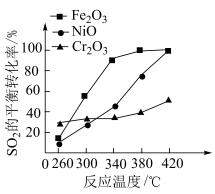
(3)上述反应的正反应速率方程为 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响, (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示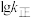 的是
的是___________ (填序号)。

(4)泡沫灭火器灭火时发生反应的离子方程式是___________ 。
(5)要使 溶液中
溶液中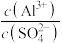 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。
(1)铁元素在元素周期表中位置为
(2)反应
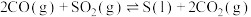
 ,其他条件相同,催化剂不同时,反应相同时间
,其他条件相同,催化剂不同时,反应相同时间 的转化率随反应温度的变化如图所示,260℃条件下选择
的转化率随反应温度的变化如图所示,260℃条件下选择 ”“
”“ ”或“
”或“ ”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择
”),作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择 作催化剂的优势是
作催化剂的优势是
(3)上述反应的正反应速率方程为
 ,逆反应速率方程为
,逆反应速率方程为 ,其中
,其中 、
、 分别为正、逆反应的速率常数,只受温度影响,
分别为正、逆反应的速率常数,只受温度影响,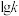 (速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示
(速率常数的对数)与温度(T)的关系符合图中的两条线,其中表示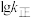 的是
的是
(4)泡沫灭火器灭火时发生反应的离子方程式是
(5)要使
 溶液中
溶液中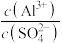 的比值增大,可加入的物质是___________。
的比值增大,可加入的物质是___________。| A.少量硫酸 | B.少量NaOH溶液 |
C.少量 固体 固体 | D.适量蒸馏水 |
您最近一年使用:0次
6 . 废SCR催化剂(含TiO2、V2O5、WO3等)的回收对环境保护和资源循环利用意义重大。通过如下工艺流程可以回收其中的钛、钒、钨等。
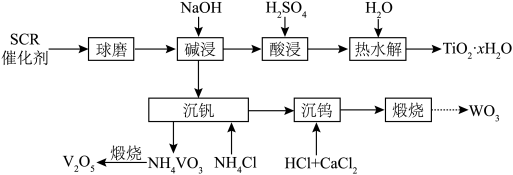
已知:TiO2、V2O5和WO3都能与NaOH溶液反应生成可溶性的NaVO3、Na2WO4和不溶性的Na2TiO3;
回答下列问题:
(1)元素V在周期表中的位置_______ 。在NH4VO3中V元素的化合价是_______ 。
(2)“球磨”的目的是_______ 。
(3)请写出“碱浸”过程中WO3与NaOH溶液反应的离子方程式_______ 。
(4)“酸浸”后钛主要以TiO2+形式存在,“热水解”反应的离子方程式为_______ 。
(5)“煅烧”NH4VO3的化学方程式为_______ 。
(6)“沉钨”中为促进CaWO4尽可能析出完全,需要进行的措施是_______ 。

已知:TiO2、V2O5和WO3都能与NaOH溶液反应生成可溶性的NaVO3、Na2WO4和不溶性的Na2TiO3;
回答下列问题:
(1)元素V在周期表中的位置
(2)“球磨”的目的是
(3)请写出“碱浸”过程中WO3与NaOH溶液反应的离子方程式
(4)“酸浸”后钛主要以TiO2+形式存在,“热水解”反应的离子方程式为
(5)“煅烧”NH4VO3的化学方程式为
(6)“沉钨”中为促进CaWO4尽可能析出完全,需要进行的措施是
您最近一年使用:0次
7 . 过渡元素钒、锰、铁、镍等在生活、科研中应用广泛。回答下列问题:
(1)钒广泛应用于航天、化工及能源等行业,与钒同周期且基态原子未成对电子数相同的元素可能位于周期表
(2)
 与水杨醛缩邻氨基苯酚
与水杨醛缩邻氨基苯酚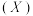 可形成黄色配合物,应用于科研光度法测定离子浓度。锰在元素周期表中的位置是
可形成黄色配合物,应用于科研光度法测定离子浓度。锰在元素周期表中的位置是 与其同分异构体
与其同分异构体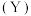 的结构如图1所示,沸点较高的是
的结构如图1所示,沸点较高的是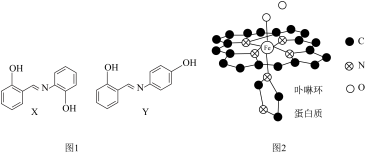
(3)铁是构成血红蛋白的必要成分,血红蛋白携氧后的配合物结构如图2所示(部分氢未画出)。中心
 的配位数为
的配位数为 与血红蛋白中
与血红蛋白中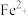 的配位能力
的配位能力 ,原因是
,原因是(4)砷化镍激光在医学上用于治疗皮肤及黏膜创面的感染及溃疡等,人工合成的砷化镍常存在各种缺陷,已知某缺陷砷化镍的组成为
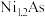 ,其中
,其中 元数只有+2和+3两种价态,则
元数只有+2和+3两种价态,则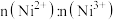 为
为
您最近一年使用:0次
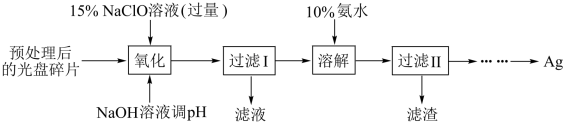
8 . 某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略):
已知:①NaClO溶液与Ag反应的产物为AgCl、NaOH和
②NaClO溶液在受热或酸性条件下易分解: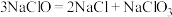
③铜和银是同族相邻元素
请回答下列问题:
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为_____ ;
(2)银元素位于元素周期表的第_____ 周期第_____ 族,属于_____ 区;
(3)“溶解”阶段中发生的反应的离子方程式为_____ ;
(4)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤液合并入_____ ;
(5)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与 反应外(该条件下
反应外(该条件下 与
与 不反应),还因为
不反应),还因为_____ 。

已知:①NaClO溶液与Ag反应的产物为AgCl、NaOH和

②NaClO溶液在受热或酸性条件下易分解:
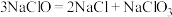
③铜和银是同族相邻元素
请回答下列问题:
(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)银元素位于元素周期表的第
(3)“溶解”阶段中发生的反应的离子方程式为
(4)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤液合并入
(5)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与
 反应外(该条件下
反应外(该条件下 与
与 不反应),还因为
不反应),还因为
您最近一年使用:0次
解题方法
9 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
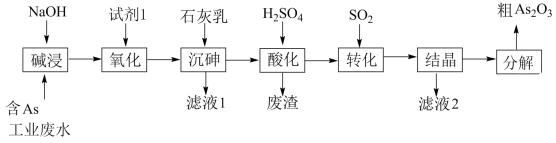
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近一年使用:0次
真题
解题方法
10 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
(1)Co位于元素周期表第_______ 周期,第_______ 族。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因_______ 。
(3)鉴别洗净的“滤饼3”和固体 常用方法的名称是
常用方法的名称是_______ 。
(4)已知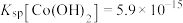 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为_______  。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为_______ 。
(5)导致 比
比 易水解的因素有
易水解的因素有_______ (填标号)。
a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: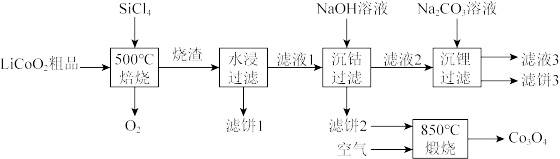
(1)Co位于元素周期表第
(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”后剩余的
的混合物,“500℃焙烧”后剩余的 应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因
应先除去,否则水浸时会产生大量烟雾,用化学方程式表示其原因(3)鉴别洗净的“滤饼3”和固体
 常用方法的名称是
常用方法的名称是(4)已知
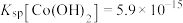 ,若“沉钴过滤”的pH控制为10.0,则溶液中
,若“沉钴过滤”的pH控制为10.0,则溶液中 浓度为
浓度为 。“850℃煅烧”时的化学方程式为
。“850℃煅烧”时的化学方程式为(5)导致
 比
比 易水解的因素有
易水解的因素有a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道
您最近一年使用:0次
2023-06-14更新
|
10929次组卷
|
13卷引用:2023年高考湖北卷化学真题
2023年高考湖北卷化学真题(已下线)专题18 工艺流程题(已下线)T16-工业流程题(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第32讲难溶电解质的溶解平衡(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)专题06 沉淀溶解平衡-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)题型四 无机化工流程题解题策略-备战2024年高考化学答题技巧与模板构建



