名校
1 . 已知 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:
(1)M元素原子的核外电子排布式为_______ 。
(2)M元素在元素周期表中的位置为_______ 。
(3)M的基态原子共有_______ 种不同能级的电子,该原子最外层电子数为_______ ,价层电子数为_______ 。
(4)某元素原子的基态电子排布式为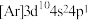 ,该元素处于元素周期表的第
,该元素处于元素周期表的第_______ 周期第_______ 族。试推测该元素处于元素周期表的_______ 区,该元素原子的价电子排布图为_______ 。
(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式_______ 。
 的3d轨道上有6个电子,试回答:
的3d轨道上有6个电子,试回答:(1)M元素原子的核外电子排布式为
(2)M元素在元素周期表中的位置为
(3)M的基态原子共有
(4)某元素原子的基态电子排布式为
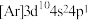 ,该元素处于元素周期表的第
,该元素处于元素周期表的第(5)与M元素相对比,铬(Cr)元素的原子核外电子排布有其特点,请写出Cr基态原子核外电子排布式
您最近一年使用:0次
2 . 分子筛是一类具有规整孔道结构的多孔材料,能够选择性吸附空间结构各异和不同尺寸的分子,在化学工业中有着广泛的应用。近年来,我国科学家在分子筛研究领域不断取得新的突破。这些研究中涉及的部分元素在周期表中位置如下:
(1)近期我国科学家制备了一种无缺陷的分子筛膜,可高效分离CH4与CO2两种气体。下列有关分子空间结构的描述正确的是_______
(2)传统的分子筛主要含有O、Na、Al和Si元素,通过调控这 4种元素的比例,可获得不同性能的分子筛产品。这4种元素描述中正确的是_______ 。
(3)通过将分子筛中的元素Na替换为K或Ca,可改变分子筛的孔径大小。这3种元素中说法正确的是_______
(4)N2常用于分子筛的孔结构测试,H、O和N元素可形成多种物质。下列说法正确的是_______
(5)某些分子筛可以选择性吸附Ar。Ar位于元素周期表的_______
| 周期 | 族 | ||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | H | ||||||
| 2 | C | N | O | ||||
| 3 | Na | Al | Si | ||||
| 4 | K | Ca | |||||
| A.CH4是平面结构 | B.CO2是V形结构 |
| C.CH4是正四面体结构 | D.CO2是直线形结构 |
| A.非金属性最强的是O |
| B.核外电子数最少的是 Na |
| C.金属性最强的是Al |
| D.原子半径最大的是Si |
| A.仅Na可与Cl2反应 |
| B.K的单质与水的反应最剧烈 |
| C.Na的氧化物与水的反应均为化合反应 |
| D.Ca的最高价氧化物的水化物碱性最强 |
| A.N2中含有共价三键 |
| B.NO可由NH3催化氧化得到 |
| C.NH3的水溶液呈碱性 |
| D.稀HNO3与Cu反应产生H2 |
| A.第二周期 | B.Ⅷ族 | C.第三周期 | D.0族 |
您最近一年使用:0次
名校
解题方法
3 . 实验室加热液体时常加入沸石,其主要成分为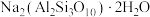 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:
(1)元素Si在周期表中的位置是_______ 。
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为_______ ;化合物乙可作为呼吸面具或潜艇氧气的来源,乙是_______ (填化学式);Na与同周期非金属性最强的元素形成的化合物可做调味品,用电子式表示该化合物的形成过程_______ 。
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是_______ (填化学式)。
(4)Na所在周期的主族元素中,简单离子半径最小的是_______ (填离子符号)
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则 中A=
中A=_______ 、Z=_______ 。
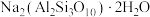 。根据其组成元素完成下列填空:
。根据其组成元素完成下列填空:(1)元素Si在周期表中的位置是
(2)沸石中的元素可形成多种化合物;Na元素与原子半径最小的元素组成化合物甲,常作强还原剂,化合物甲的电子式为
(3)与氧元素同周期的非金属元素中,简单气态氢化物最稳定的是
(4)Na所在周期的主族元素中,简单离子半径最小的是
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则
 中A=
中A=
您最近一年使用:0次
解题方法
4 . 核酸检测是常态化疫情防控的手段之一,核酸采样管中的红色液体是病毒核酸保存液,其成分之一的盐酸胍[结构简式为 ]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
(1)下表是元素周期表中的短周期部分,请将盐酸胍中四种元素的元素符号填写在表中的相应位置。_____
(2)N位于元素周期表的第_______ 周期,第_______ 族。
(3)推测C、N的非金属性强弱:_______ 大于_______ 。
(4)HCl中所含化学键属于_______ ,请用电子式表示HCl的形成过程:_______ 。
 ]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:
]的主要作用是使蛋白质变性并抑制酶活性。请回答以下问题:(1)下表是元素周期表中的短周期部分,请将盐酸胍中四种元素的元素符号填写在表中的相应位置。

(2)N位于元素周期表的第
(3)推测C、N的非金属性强弱:
(4)HCl中所含化学键属于
您最近一年使用:0次
5 . 分析下列图表,回答问题。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
则该元素是_______ (填写元素符号)。
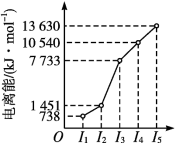
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第_______ 族。
(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价层电子排布式:_______ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_______ 。
(1)N、Al、Si、Ge四种元素中,某种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/( kJ∙mol−1) | 578 | 1 817 | 2 745 | 11 575 | …… |
(2)短周期某主族元素M的电离能情况如图所示。则M元素位于周期表的第

(3)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| I1 | 717 | 759 | |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
您最近一年使用:0次
2023高三·全国·专题练习
6 . 元素周期表中的特殊位置_______

(1)请在上表中画出元素周期表的轮廓,并标出周期序数和族序数。
(2)画出金属与非金属的分界线,写出分界线处金属的元素符号,并用阴影表示出过渡元素的位置。
(3)写出各周期元素的种类。
(4)写出稀有气体元素的原子序数。
(5)标出113号~118号元素的位置。
(6)根据元素原子价电子排布的特征,标出元素周期表分区情况。

(1)请在上表中画出元素周期表的轮廓,并标出周期序数和族序数。
(2)画出金属与非金属的分界线,写出分界线处金属的元素符号,并用阴影表示出过渡元素的位置。
(3)写出各周期元素的种类。
(4)写出稀有气体元素的原子序数。
(5)标出113号~118号元素的位置。
(6)根据元素原子价电子排布的特征,标出元素周期表分区情况。
您最近一年使用:0次
名校
7 . 下图为元素周期表的一部分,请参照① ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
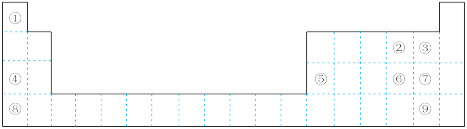
(1)最高价氧化物对应水化物碱性最强的是_______ (填化学式),氢化物热稳定性最强的是_______ (填电子式)。
(2)②③④的原子半径从大到小的顺序是_______ (填元素符号)。④⑤⑧的阳离子中氧化性最强的是_______ (填离子符号)。
(3)元素⑥的非金属性比⑦_______ (填“强”或“弱”),请从原子结构的角度解释:_______ 。
(4)现在含有元素硒( )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为_______ ,则下列叙述中正确的是_______ 。
A.原子序数为
B.气态氢化物的稳定性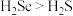
C. 不能与氢氧化钠反应
不能与氢氧化钠反应
D. 既有氧化性又有还原性
既有氧化性又有还原性
(5)①和④可形成 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为_______ ,其与水反应放出气体的化学方程式为_______ 。
 ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是
(2)②③④的原子半径从大到小的顺序是
(3)元素⑥的非金属性比⑦
(4)现在含有元素硒(
 )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为A.原子序数为
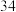
B.气态氢化物的稳定性
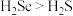
C.
 不能与氢氧化钠反应
不能与氢氧化钠反应D.
 既有氧化性又有还原性
既有氧化性又有还原性(5)①和④可形成
 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
2023-02-05更新
|
278次组卷
|
2卷引用:湖南省郴州市苏仙区多校2022-2023学年高一上学期期末线上联考化学试题
名校
8 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置
请回答下列问题:
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是_______ 。
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:_______ 。
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为_______
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是_______ (填化学式;用“>”连接)。
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断_______ (填“正确”或“错误”);根据元素周期律,自然界中最强的碱是_______ (填化学式)。
族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | |||||
| 4 | ⑨ |
(1)考古工作者利用某元素的一种核素测定一些文物的年代,这种核素的元素符号是
(2)写出由元素②和元素④形成原子个数比为1∶2的化合物的电子式:
(3)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)表中的ⅠA族、ⅡA族元素全部是金属元素,这种判断
您最近一年使用:0次
2023-01-16更新
|
427次组卷
|
4卷引用:山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题
山东省莘县多校2022-2023学年高一上学期期末线上联考化学试题(已下线)【知识图鉴】单元讲练测必修第一册第四单元03巩固练安徽省六安市金寨县青山中学2023-2024学年高一下学期第一次月考化学试题江西省宜春市万载县万载二中 2023?2024 学年高一上学期期末模拟考试化学试卷
名校
解题方法
9 . 下图是元素周期表的一部分。
(1)①-⑩元素中最稳定的原子是_______ (填元素符号);形成的气态氢化物稳定性最强的是_______ (填氢化物的化学式)。
(2)②的最高价氧化物的电子式为_______ ;用电子式表示⑤和⑥形成化合物的过程:_______ 。
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为_______ 。
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知 是不溶于水的白色胶状沉淀,
是不溶于水的白色胶状沉淀, 易挥发。
易挥发。
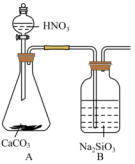
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗_______ (答“合理”或“不合理”),原因是_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)①-⑩元素中最稳定的原子是
(2)②的最高价氧化物的电子式为
(3)①和⑦金属性相似,①的最高价氧化物对应的水化物与KOH溶液反应的离子方程式为
(4)某同学设计了如下实验证明非金属性③>②>⑧。已知
 是不溶于水的白色胶状沉淀,
是不溶于水的白色胶状沉淀, 易挥发。
易挥发。
该同学打开分液漏斗活塞,观察到A中产生气泡,B中出现白色胶状沉淀即认为非金属性③>②>⑧。请问该同学的结论合理吗
您最近一年使用:0次
解题方法
10 . 图为元素周期表的一部分,请参照①~⑧在表中的位置,回答下列问题:

(1)⑥在周期表中的位置是_______ 。
(2)①~⑧中,化学性质最稳定的是_______ (填元素符号),非金属性最强的是_______ (填元素符号),最高价氧化物对应水化物酸性最强的是_______ (填化学式)。
(3)元素③的非金属性比⑥_______ (填“强”或“弱”),元素③④⑤原子半径由大到小的顺序:_______ (填元素符号)。

(1)⑥在周期表中的位置是
(2)①~⑧中,化学性质最稳定的是
(3)元素③的非金属性比⑥
您最近一年使用:0次



