解题方法
1 . 下表是元素周期表的一部分。
请完成下列填空
(1) 的结构示意图为
的结构示意图为___________ 。
(2)第三周期中,最高价氧化物水化物酸性最强的是___________ (填化学式)。
(3)Mg、Cl和Ca中,离子半径由大到小的顺序是___________ (用离子符号表示)。
(4) 的电子式为
的电子式为___________ ; 结构式为
结构式为___________ 。
(5)写出一个能证明Cl的非金属性强于Br的离子方程式___________ 。
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在S的下方,下列推断正确的是___________(填字母序号)
(7)元素周期表中,某些主族元素与右下方的主族元素的性质具有相似性,如Be与Al,这种规律称为“对角线原则”。 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为___________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | Be | C | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | |||
| 4 | Ca | Se | Br |
(1)
 的结构示意图为
的结构示意图为(2)第三周期中,最高价氧化物水化物酸性最强的是
(3)Mg、Cl和Ca中,离子半径由大到小的顺序是
(4)
 的电子式为
的电子式为 结构式为
结构式为(5)写出一个能证明Cl的非金属性强于Br的离子方程式
(6)硒(Se)被誉为“生命元素”,科学补硒可以减少疾病的发生。周期表中元素Se的位置在S的下方,下列推断正确的是___________(填字母序号)
A. 具有还原性 具有还原性 |
B. 的稳定性比 的稳定性比 强 强 |
C. 的酸性强于 的酸性强于 |
D. 在一定条件下可与NaOH溶液反应 在一定条件下可与NaOH溶液反应 |
 与NaOH溶液反应的离子方程式为
与NaOH溶液反应的离子方程式为
您最近一年使用:0次
2 . 立方砷化硼具有高载流子迁移率,超越硅的导热、导电性能,有望成为硅基元器件的替代方案,其晶胞结构如图所示,请回答下列问题:
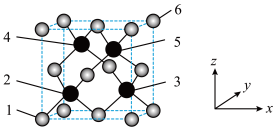
(1)As在元素周期表中的位置是_______ 。As属于_______ 区元素。
(2)该晶胞的化学式为_______ 。2、3、4、5四个原子所围成的空间结构为_______ 形。
(3)晶胞有两个基本要素。
①原子坐标参数,表示晶胞内部各原子的相对位置,图中1号原子的坐标参数为 ,6号原子的坐标参数为
,6号原子的坐标参数为 ,则2号原子的坐标参数为
,则2号原子的坐标参数为_______ 。
②晶胞参数是用来描述晶胞大小和形状的,设该晶胞的晶胞参数为a pm,阿伏加德罗常数为 ,则B、As原子之间的最短距离为
,则B、As原子之间的最短距离为_______ pm,该晶胞的密度为_______  。
。

(1)As在元素周期表中的位置是
(2)该晶胞的化学式为
(3)晶胞有两个基本要素。
①原子坐标参数,表示晶胞内部各原子的相对位置,图中1号原子的坐标参数为
 ,6号原子的坐标参数为
,6号原子的坐标参数为 ,则2号原子的坐标参数为
,则2号原子的坐标参数为②晶胞参数是用来描述晶胞大小和形状的,设该晶胞的晶胞参数为a pm,阿伏加德罗常数为
 ,则B、As原子之间的最短距离为
,则B、As原子之间的最短距离为 。
。
您最近一年使用:0次
解题方法
3 . 请将表格补充完整:
| 原子电子排布式 | 族 | 周期 | 区 |
| ①1s22s22p63s2 | |||
| ②[Kr]4d105s25p2 | |||
| ③[Ar]3d14s2 | |||
| ④[Ar]3d104s1 |
您最近一年使用:0次
2022-08-28更新
|
913次组卷
|
2卷引用:第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表
4 . I.我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Ba、As三种元素组成,这为进一步理解超导配对机理及其与电荷密度波的关系提供了重要实验证据。回答下列问题:
(1)As元素属于元素周期表的___________ 区元素,其价电子排布式是___________ 。
(2)基态Fe原子核外电子排布式为___________ 。
Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有___________ 种。
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的___________ 区(用符号填空),原子序数最大的在周期表的第___________ 周期、___________ 族。
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+___________ (填“无”或“有”)颜色。
(1)As元素属于元素周期表的
(2)基态Fe原子核外电子排布式为
Ⅱ.某元素原子的最外电子层只有一个电子,该电子的电子层数n=4。请回答下列问题:
(3)符合上述条件的元素共有
(4)在符合上述条件的元素中,原子序数最小的在元素周期表中的
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+
您最近一年使用:0次
名校
解题方法
5 . 如表是元素周期表的一部分。表中所列的字母分别代表一种化学元素:
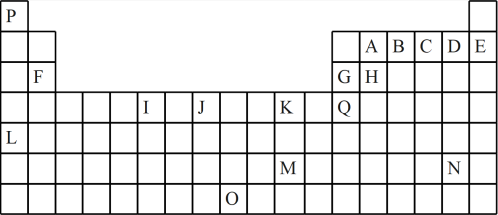
(1)I的最高化合价为____ ;K的元素名称为____ 。
(2)基态时G元素原子的电子排布式___ ,J元素原子的外围电子排布式___ 。
(3)下列对比正确的是___ 。
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是____ 。
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b. O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)元素B和C的气态氢化物热稳定性较强的是____ (填化学式)。

(1)I的最高化合价为
(2)基态时G元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A b.第一电离能E>D>C>B
c.电负性A>H>G>Q d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第5周期ⅠA族,属于s区元素
b. O位于元素周期表中第7周期ⅧB族,属于d区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
(5)元素B和C的气态氢化物热稳定性较强的是
您最近一年使用:0次
名校
6 . 联合国大会将2019年定为“化学元素周期表国际年”,高度体现了元素周期表的重要性,图中表示了元素周期表短周期的一部分,①~⑦代表7种短周期元素。
(1)写出七种元素中化学性质最不活泼的元素形成的单质的化学式_______ 。
(2)元素②的最低价阴离子的离子结构示意图是_______ 。
(3)②、⑤两种元素的最简单氢化物中稳定性较强的是_______ (填化学式)。
(4)⑤、⑥两种元素的最高价氧化物对应的水化物中,酸性较弱的是_______ (填化学式)。
(5)元素③最高价氧化物对应水化物与元素④的单质反应的离子方程式为:_______ 。
| ① | ② | |||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ |
(1)写出七种元素中化学性质最不活泼的元素形成的单质的化学式
(2)元素②的最低价阴离子的离子结构示意图是
(3)②、⑤两种元素的最简单氢化物中稳定性较强的是
(4)⑤、⑥两种元素的最高价氧化物对应的水化物中,酸性较弱的是
(5)元素③最高价氧化物对应水化物与元素④的单质反应的离子方程式为:
您最近一年使用:0次
2022-04-09更新
|
536次组卷
|
2卷引用:云南省昆明市第一中学2021-2022学年高一上学期期末考试化学试题
名校
7 . 如图是元素周期表的一部分,A~J代表对应的元素,回答下列问题:
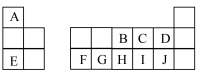
(1)F的元素符号为___________ ,元素C在周期表中的位置为___________ 。
(2)A、D和E三种元素的离子半径由大到小的顺序是___________ (用离子符号表示)。
(3)图中对应元素最高价氧化物的水化物中,碱性最强的是___________ (填化学式)。
(4)A、B和J三种元素形成常见化合物所含化学键的类型是___________ 。
(5)下列说法错误的是___________ (填标号)。
a.单质的熔点:
b.简单氢化物的沸点:
c.氧化物对应水化物的酸性:
(6)元素F的单质与元素E的最高价氧化物对应水化物反应的离子方程式为___________ 。

(1)F的元素符号为
(2)A、D和E三种元素的离子半径由大到小的顺序是
(3)图中对应元素最高价氧化物的水化物中,碱性最强的是
(4)A、B和J三种元素形成常见化合物所含化学键的类型是
(5)下列说法错误的是
a.单质的熔点:

b.简单氢化物的沸点:

c.氧化物对应水化物的酸性:

(6)元素F的单质与元素E的最高价氧化物对应水化物反应的离子方程式为
您最近一年使用:0次
2023-09-12更新
|
453次组卷
|
2卷引用:安徽省皖江名校联考2023-2024学年高二上学期开学化学试题
解题方法
8 . 请根据构造原理,按要求写出下列电子排布式或原子结构示意图:
(1)16S的电子排布式___________ 。
(2)26Fe的简化电子排布式___________ 。
(3)某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
①该元素处于元素周期表的第___________ 周期。
②该元素处于元素周期表的第___________ 族。
③试推测该元素处于元素周期表的___________ 区。
(1)16S的电子排布式
(2)26Fe的简化电子排布式
(3)某元素原子的电子排布式为[Ar]3d104s24p1,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
①该元素处于元素周期表的第
②该元素处于元素周期表的第
③试推测该元素处于元素周期表的
您最近一年使用:0次
名校
解题方法
9 . 下表列出了A~R9种元素在周期表中的位置。请回答下列问题。
(1)在这9种元素中,最外层电子数为1的元素为_____ (填元素符号),化学性质最不活泼的是_____ (填元素符号)。
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应水化物反应的离子方程式是_____ 。
(3)F、A、D三种元素的离子半径由大到小的顺序排列为_____ (填离子符号)。
(4)用电子式表示由C和H组成的化合物的形成过程:_____ 。
(5)由E和F形成的氧化物通入足量的B的氢氧化物中,其离子反应方程式为_____ 。
(6)由E和G所形成的化合物中所含有的化学键为_____ 。
| 周期 | 族 | |||||||
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H | ||||||
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应水化物反应的离子方程式是
(3)F、A、D三种元素的离子半径由大到小的顺序排列为
(4)用电子式表示由C和H组成的化合物的形成过程:
(5)由E和F形成的氧化物通入足量的B的氢氧化物中,其离子反应方程式为
(6)由E和G所形成的化合物中所含有的化学键为
您最近一年使用:0次
2023-12-24更新
|
440次组卷
|
2卷引用:湖南省长郡中学2023-2024学年高一上学期选科适应性调研检测化学试题
2021高一·全国·专题练习
名校
10 . 下表是元素周期表的一部分,请用化学符号回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为___________ 。
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是___________ ,最高价氧化物的水化物中酸性最强的是___________ 。
(3)第三周期元素形成的简单离子中半径最小的微粒是___________ ,写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式___________ 、___________ 。
| 主族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是
(3)第三周期元素形成的简单离子中半径最小的微粒是
您最近一年使用:0次
2021-12-06更新
|
1083次组卷
|
4卷引用:专题4.2.1 元素性质的周期性变化规律(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)
(已下线)专题4.2.1 元素性质的周期性变化规律(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)浙江省舟山市舟山中学2021-2022学年高一下学期开学考试化学试题山东省“学情空间”区域教研共同体2022-2023学年高一上学期12月联考(人教版) 化学试题安徽省芜湖市第一中学2022-2023学年高一上学期选科分班考试化学试题



