1 . 已知某主族元素的原子结构示意图如下,请写出它们在周期表中的位置。
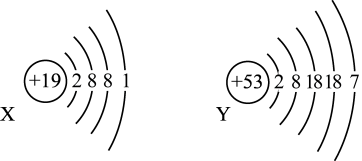
X:_______ ,Y:_______ 。

X:
您最近一年使用:0次
2022-04-28更新
|
558次组卷
|
2卷引用:上海市青浦区第一中学2021-2022学年高一下学期期中线上质量检测化学试题
解题方法
2 . Ⅰ.周期表可以帮我们认识一些未知元素的性质。锡(Sn)是很早便被发现和使用的金属,其原子结构示意图见下图。
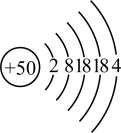
(1)锡为主族元素,在元素周期表中的位置是_______ 。 其最高正价为_______ 。
(2)SnO2能与NaOH反应生成钠盐,写出反应的化学方程式_______ 。
Ⅱ.硒与硫在元素周期表中相对位置如图所示。
(3)硒元素最高价氧化物对应水化物的化学式为_______ , 写出SeO2和H2Se反应的化学方程式_______ 。
(4)比较气态氢化物H2S、H2Se 的热稳定性_______ ,从原子结构及周期律角度分析气态氢化物稳定性强弱的原因:_______ 。

(1)锡为主族元素,在元素周期表中的位置是
(2)SnO2能与NaOH反应生成钠盐,写出反应的化学方程式
Ⅱ.硒与硫在元素周期表中相对位置如图所示。
| S |
| Se |
(4)比较气态氢化物H2S、H2Se 的热稳定性
您最近一年使用:0次
名校
3 . 氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生产氮肥的原料。回答下列问题:
(1)与氮元素不在同一周期的元素是____ (填标号)。
a.氢 b.碳 c.氧 d.硅
(2)氨的电子式是____ 。
(3)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是____ 。
(1)与氮元素不在同一周期的元素是
a.氢 b.碳 c.氧 d.硅
(2)氨的电子式是
(3)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是
您最近一年使用:0次
名校
4 . 下表是元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题。
(1)画出①和③两种元素的原子1:2组成的化合物的电子式_______ 。
(2)元素①-⑩中化学性质最不活泼的元素是_______ (填元素符号)。
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是_______ (填离子符号)。
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为_______ 。
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有_______ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)元素①-⑩中化学性质最不活泼的元素是
(3)在③、④、⑤、⑥这些元素形成的最简单离子中,离子半径由大到小的顺序是
(4)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生的化学方程式为
(5)由元素③、⑤、⑨形成的一种常见的杀菌消毒剂中存在的化学键有
您最近一年使用:0次
2022-04-04更新
|
400次组卷
|
2卷引用:四川省自贡市富顺县城关中学2021-2022学年高一下学期期中考试化学试题
名校
5 . 下表为元素周期表的一部分,表中序号各代表某一元素。请回答下列问题。
(1)③的原子结构示意图是___________ 。
(2)①~⑨中非金属性最强的元素是___________ (填化学式)。
(3)①和⑨两种元素组成的化合物的电子式___________
(4)元素⑦和⑨组成的化合物中含有的化学键是___________ (填“共价键”或“离子键”)。
(5)元素①的名称为___________ 。
(6)元素⑤的最高价氧化物的水化物为___________ (填化学式)
 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑦ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑨ | |||
| 4 | ② | ④ |
(2)①~⑨中非金属性最强的元素是
(3)①和⑨两种元素组成的化合物的电子式
(4)元素⑦和⑨组成的化合物中含有的化学键是
(5)元素①的名称为
(6)元素⑤的最高价氧化物的水化物为
您最近一年使用:0次
2022-03-20更新
|
438次组卷
|
2卷引用:黑龙江省鸡西市英桥高级中学2021-2022学年高一下学期期中考试化学试题
名校
6 . 1869年俄国科学家门捷列夫绘制出了第一张元素周期表,成为化学史上的里程碑之一,且大大地促进了化学学科的快速发展。下表是现代元素周期表的一部分,请据表回答下列问题:
(1)元素③的名称是___________ ,金属性最强的元素是___________ (填元素符号)。
(2)①②⑤三种元素原子半径由大到小的顺序为___________ (填序号)。
(3)元素⑦的单质的一种用途是___________ (填写“制造玻璃”或“制造计算机芯片”)。
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是___________ (填化学式)。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
二 | ① | ② | ③ | ||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)元素③的名称是
(2)①②⑤三种元素原子半径由大到小的顺序为
(3)元素⑦的单质的一种用途是
(4)元素⑧⑨⑩最高价氧化物的水化物中酸性最强的是
您最近一年使用:0次
2022-03-16更新
|
640次组卷
|
3卷引用:湖南省长沙市长郡中学2020-2021学年高一下学期期中考试化学试题
名校
7 . 下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
(1)金属性最强的是___________ (填元素名称)。
(2)⑨的离子结构示意图为___________ 。
(3)⑤元素和⑩元素的最简单氢化物的稳定性由强到弱的关系是___________ (填化学式)。
(4)④、⑤、⑥的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(5)⑧、⑨、⑩最高价氧化物对应的水化物酸性由弱到强的顺序是___________ (填化学式)
(6)用电子式表示④与⑥形成的原子个数比为1 ∶2的化合物的形成过程___________ 。
(7)⑧单质与⑥的最高价氧化物水化物的溶液发生反应,写出生成的阴离子为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(2)⑨的离子结构示意图为
(3)⑤元素和⑩元素的最简单氢化物的稳定性由强到弱的关系是
(4)④、⑤、⑥的简单离子半径由大到小的顺序为
(5)⑧、⑨、⑩最高价氧化物对应的水化物酸性由弱到强的顺序是
(6)用电子式表示④与⑥形成的原子个数比为1 ∶2的化合物的形成过程
(7)⑧单质与⑥的最高价氧化物水化物的溶液发生反应,写出生成的阴离子为
您最近一年使用:0次
2022-01-22更新
|
527次组卷
|
3卷引用:宁夏青铜峡市宁朔中学、吴忠中学青铜峡分校2021-2022学年高一下学期期中考试化学试题
8 . 下表是元素周期表的一部分。表中所列字母分别代表一种元素。
回答下列问题:
(1)j在元素周期表中的位置是______ 。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________ 。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______ 色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______ 。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____ Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______ 。
| a | b | |||||||
| c | d | e | f | |||||
| g | h | i | j | k | l | m | ||
| n |
(1)j在元素周期表中的位置是
(2)e、h、m形成的简单离子其半径由大到小的顺序为
(3)n与g形成的化合物为
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释
您最近一年使用:0次
2022-01-14更新
|
785次组卷
|
4卷引用:【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】
(已下线)【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】湖南省怀化市2021-2022学年高一上学期期末考试化学试题(已下线)第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)湖北省孝感市新高考联考协作体2022-2023学年高二上学期9月联考化学试题
名校
9 . 《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)Be在周期表中的位置:___________ , 10Be和9Be___________ (填序号)。
a. 是同一种原子 b. 具有相同的中子数 c. 具有几乎相同的化学性质 d. 互为同位素
(2)写出Al(OH)3与NaOH溶液反应的化学方程式:___________ 。
(3)研究表明28Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是___________(填序号)。
(1)Be在周期表中的位置:
a. 是同一种原子 b. 具有相同的中子数 c. 具有几乎相同的化学性质 d. 互为同位素
(2)写出Al(OH)3与NaOH溶液反应的化学方程式:
(3)研究表明28Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是___________(填序号)。
| A.比较Mg(OH)2与Al(OH)3的碱性强弱 |
| B.比较这两种元素的最高正化合价 |
| C.将打磨过表面积相同的镁条和铝片分别和100℃热水作用,并滴入酚酞溶液 |
| D.比较这两种金属的硬度和熔点 |
您最近一年使用:0次
名校
10 . 铁、铝和铜是人类使用最广泛的金属。回答下列问题:
(1)根据电子排布的特点,Al位于元素周期表的__ (填标号,下同),Fe位于元素周期表的__ 。
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为__ ,在元素周期表中位于第__ 周期,基态Cu+的电子排布式为__ 。
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为__ 。
(1)根据电子排布的特点,Al位于元素周期表的
a.s区 b.p区 c.d区 d.ds区
(2)63Cu和65Cu互称为
(3)经研究发现目前铁的最高价为+6价,其+6价化合物Na2FeO4在硫酸存在的条件下,可将Mn2+氧化为MnO
 ,而自身被还原为Fe3+,该反应的离子方程式为
,而自身被还原为Fe3+,该反应的离子方程式为
您最近一年使用:0次
2022-01-09更新
|
228次组卷
|
2卷引用:辽宁省辽河油田第二高级中学2021-2022学年高二上学期期中考试化学试题



