名校
1 . 下图为元素周期表的一部分,请参照① ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
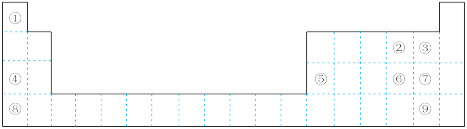
(1)最高价氧化物对应水化物碱性最强的是_______ (填化学式),氢化物热稳定性最强的是_______ (填电子式)。
(2)②③④的原子半径从大到小的顺序是_______ (填元素符号)。④⑤⑧的阳离子中氧化性最强的是_______ (填离子符号)。
(3)元素⑥的非金属性比⑦_______ (填“强”或“弱”),请从原子结构的角度解释:_______ 。
(4)现在含有元素硒( )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为_______ ,则下列叙述中正确的是_______ 。
A.原子序数为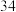
B.气态氢化物的稳定性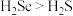
C. 不能与氢氧化钠反应
不能与氢氧化钠反应
D. 既有氧化性又有还原性
既有氧化性又有还原性
(5)①和④可形成 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为_______ ,其与水反应放出气体的化学方程式为_______ 。
 ⑨在表中的位置,回答下列问题:
⑨在表中的位置,回答下列问题:
(1)最高价氧化物对应水化物碱性最强的是
(2)②③④的原子半径从大到小的顺序是
(3)元素⑥的非金属性比⑦
(4)现在含有元素硒(
 )的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多
)的保健品开始进入市场,已知硒元素与氧元素同主族,比氧多 个电子层,硒在周期表中的位置为
个电子层,硒在周期表中的位置为A.原子序数为
B.气态氢化物的稳定性
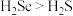
C.
 不能与氢氧化钠反应
不能与氢氧化钠反应D.
 既有氧化性又有还原性
既有氧化性又有还原性(5)①和④可形成
 型离子化合物,该离子化合物的电子式为
型离子化合物,该离子化合物的电子式为
您最近一年使用:0次
2023-02-05更新
|
278次组卷
|
2卷引用:湖南省长沙市宁乡一中2022-2023学年高一下学期期中测试化学试题
名校
解题方法
2 . 一氯化碘(ICl)是一种卤素互化物,与卤素单质性质相似,可用于制农药等。
(1)Cl在元素周期表中位于第三周期、第_______ 族。
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为_______ 价。
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,_______ ,得电子能力Cl强于I。
(4)下列推断中,正确的是_______ (填字母)。
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
(1)Cl在元素周期表中位于第三周期、第
(2)Cl的最高价氧化物对应的水化物为HClO4,其中Cl元素的化合价为
(3)Cl的非金属性强于I的,用原子结构解释原因:Cl和I位于同一主族,最外层电子数相同,
(4)下列推断中,正确的是
a.ICl有氧化性
b.热稳定性:HI>HCl
c.I的最高价氧化物对应的水化物为HIO4
您最近一年使用:0次
2023-01-17更新
|
273次组卷
|
2卷引用:北京市第八十中学2023-2024学年高一下学期期中考试化学试题
解题方法
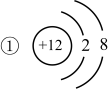
3 . 根据下列几种粒子的结构示意图,回答问题
 、
、 、
、 、
、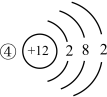
(1)其中属于阴离子的是_______ 。
(2)在化学反应中容易失去电子的是_______ 。
(3)属于同种元素的是_______ 。
 、
、 、
、 、
、
(1)其中属于阴离子的是
(2)在化学反应中容易失去电子的是
(3)属于同种元素的是
您最近一年使用:0次
解题方法
4 . 原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)指出31号元素镓(Ga)在元素周期表中的位置:_______ 周期_______ 族。
(2)X原子在第二电子层上只有一个空轨道,则X是_______ ;其轨道表示式为_______ 。
(3)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:_______ 。
(4)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:_______ 。
(5)写出3p轨道上有2个未成对电子的元素符号:_______ 。
(6)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:_______ 。
(1)指出31号元素镓(Ga)在元素周期表中的位置:
(2)X原子在第二电子层上只有一个空轨道,则X是
(3)被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:
(4)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:
(5)写出3p轨道上有2个未成对电子的元素符号:
(6)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1,该元素的名称为:
您最近一年使用:0次
2022-12-20更新
|
290次组卷
|
2卷引用:山东省威海市文登新一中2021-2022学年高二上学期期中考试化学试题
解题方法
5 . 铁、铝在生产生活中有广泛的应用。完成下列填空:
(1)铝用作电线是利用了铝的_______ 性;铁用作炊具是利用了铁的_______ 性。
(2)常温下由于浓硫酸能使铁_______ ,因此浓硫酸可用铁槽车运输。
(3)氢氧化铝既能跟盐酸反应又能跟氢氧化钠溶液反应,由此可知氢氧化铝是_______ 物质。氢氧化铝和盐酸反应的离子方程式为_______ 。
(4)氯元素原子结构示意图为_______ ,其与钠元素组成的化合物的电子式为_______ 。
(5)钠、铝、铁三种金属元素中,_______ (填名称)是地壳中含量最高的金属元素,其在周期表中位于第_______ 周期_______ 族。
(6)以下不是铝和铁的共同性质的是_______ 。
a.导电性 b.导热性 c.延展性 d.两性
(7)列举一个可以说明氯和硫的非金属性强弱的事实用化学方程式表示_______ 。
(1)铝用作电线是利用了铝的
(2)常温下由于浓硫酸能使铁
(3)氢氧化铝既能跟盐酸反应又能跟氢氧化钠溶液反应,由此可知氢氧化铝是
(4)氯元素原子结构示意图为
(5)钠、铝、铁三种金属元素中,
(6)以下不是铝和铁的共同性质的是
a.导电性 b.导热性 c.延展性 d.两性
(7)列举一个可以说明氯和硫的非金属性强弱的事实用化学方程式表示
您最近一年使用:0次
6 . 某学习小组探究B及其化合物的性质。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。
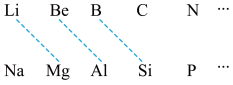
B在元素周期表中的位置是_______ 。其最高价氧化物的化学式为_______ ,与氢氧化钠溶液反应的化学方程式为_______ 。
(2)某科研团队研究发现硼氢化钠( )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
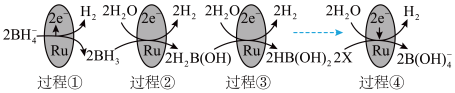
①上图中X的化学式为_______ 。
② 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用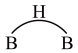 表示,则二聚物结构式为
表示,则二聚物结构式为_______ 。
③图中反应的总化学方程式为_______ 。
④_______ g 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
(1)元素周期表中虚线相连的元素的性质具有一定的相似性,即对角线法则。

B在元素周期表中的位置是
(2)某科研团队研究发现硼氢化钠(
 )在催化剂表面与水反应可生成
)在催化剂表面与水反应可生成 。
。
①上图中X的化学式为
②
 以二聚物的形式存在,分子结构中存在两个
以二聚物的形式存在,分子结构中存在两个 键共用一对共用电子的氢桥键,用
键共用一对共用电子的氢桥键,用 表示,则二聚物结构式为
表示,则二聚物结构式为③图中反应的总化学方程式为
④
 的还原能力与标准状况下22.4L
的还原能力与标准状况下22.4L 的还原能力相当(还原能力即生成
的还原能力相当(还原能力即生成 失去电子的量)。
失去电子的量)。
您最近一年使用:0次
解题方法
7 . 按要求完成下列问题。
(1)硒(Se)是人体必需的微量元素,与O为同一主族元素,Se原子比O原子多两个电子层,则Se的原子序数为____ ,其最高价氧化物对应的水化物化学式为____ 。
(2)X射线衍射法可以测定某些分子结构,NH3分子结构为_____ 。
(3)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在____ 。
(4)漂白粉(有效成分Ca(ClO)2)与空气中CO2和水蒸气反应的化学方程式:____ 。
(5)完成氧化还原反应的离子方程式:____ 。
Cr2O +Fe2++_____=Cr3++Fe3++____
+Fe2++_____=Cr3++Fe3++____
(6)一定条件下金属钠和H2反应生成甲,甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。化合物甲和NaAlH4都是重要的还原剂。将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2。
①甲的化学式____ 。
②甲与AlCl3反应得到NaAlH4的化学方程式:____ 。
③NaAlH4与水发生氧化还原反应的化学方程式:____ 。
④甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式:____ 。
(1)硒(Se)是人体必需的微量元素,与O为同一主族元素,Se原子比O原子多两个电子层,则Se的原子序数为
(2)X射线衍射法可以测定某些分子结构,NH3分子结构为
(3)水在液态时,几个水分子可以形成缔合水分子(H2O)n的原因是水分子之间存在
(4)漂白粉(有效成分Ca(ClO)2)与空气中CO2和水蒸气反应的化学方程式:
(5)完成氧化还原反应的离子方程式:
Cr2O
 +Fe2++_____=Cr3++Fe3++____
+Fe2++_____=Cr3++Fe3++____(6)一定条件下金属钠和H2反应生成甲,甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。化合物甲和NaAlH4都是重要的还原剂。将4.80g甲加热至完全分解,得到金属钠和2.24L(已折算成标准状况)的H2。
①甲的化学式
②甲与AlCl3反应得到NaAlH4的化学方程式:
③NaAlH4与水发生氧化还原反应的化学方程式:
④甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式:
您最近一年使用:0次
2022-11-16更新
|
160次组卷
|
2卷引用:天津市部分区2022-2023学年高三上学期期中考试化学试题
解题方法
8 . 近日,中国科学院深圳先进技术研究院某研究团队发现,二维铜铟磷硫(CuInP2S6)能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。
请回答下列问题:
(1)中国科学院张青莲院士主持测定的铟(49In)元素的相对原子质量的新值已被采用为国际新标准。已知铟与铷同周期,则In在元素周期表中的位置为______ ;其最高价氧化物能用于金属反射镜面的保护涂层、光电显示半导体薄膜,则铟元素的最高价氧化物的化学式为______ 。
(2)已知Cu2O在酸性条件下易歧化,据此写出Cu2O与稀硫酸反应的离子方程式:____________ 。
(3)磷、硫元素的最高价氧化物对应水化物的酸性由强到弱的顺序为______ (用化学式表示),结合元素周期律解释其原因:____________ 。
(4)已知NH4Cl与PH4I的性质相似,则对PH4I性质的推测正确的是______ (填序号)。
a.含有离子键和共价键
b.能与NaOH溶液反应
c.与NH4Cl加热充分分解产物的种类完全一样
请回答下列问题:
(1)中国科学院张青莲院士主持测定的铟(49In)元素的相对原子质量的新值已被采用为国际新标准。已知铟与铷同周期,则In在元素周期表中的位置为
(2)已知Cu2O在酸性条件下易歧化,据此写出Cu2O与稀硫酸反应的离子方程式:
(3)磷、硫元素的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)已知NH4Cl与PH4I的性质相似,则对PH4I性质的推测正确的是
a.含有离子键和共价键
b.能与NaOH溶液反应
c.与NH4Cl加热充分分解产物的种类完全一样
您最近一年使用:0次
2022-11-15更新
|
172次组卷
|
4卷引用:河南省安阳市2022-2023学年高三上学期期中考试化学试题
名校
解题方法
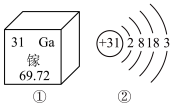
9 . 2019年是元素周期表年,镓是门捷列夫曾经预言的金属(类铝)。下图①是镓元素在元素周期表中的部分信息,②是镓原子的结构示意图。请回答:
A.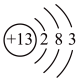 B.
B. 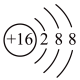 C.
C.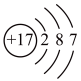 D.
D.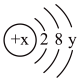
(1)镓原子的核电荷数为_______ ,镓元素的相对原子质量为_______ 。自然界中的镓共有两种稳定的同位素,其中69Ga的丰度为64.0%,则另一种镓的同位素质量数为_______ 。
(2)A、B、C三种微粒所属元素与镓元素化学性质相似的是_______ (填元素符号);微粒B的电子式为_______ ,则镓离子与B形成的化合物为_______ (填化学式)。
(3)D为某微粒的结构示意图,已知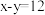 ,则x=
,则x=_______ ;写出C和D组成的化合物在水溶液中的电离方程式:_______ 。
(4)氮化镓(GaN)是第三代半导体材料,一般采用 与
与 在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为
在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为_______ 。

A.
 B.
B.  C.
C. D.
D.
(1)镓原子的核电荷数为
(2)A、B、C三种微粒所属元素与镓元素化学性质相似的是
(3)D为某微粒的结构示意图,已知
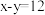 ,则x=
,则x=(4)氮化镓(GaN)是第三代半导体材料,一般采用
 与
与 在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为
在一定条件下反应制得,同时得到另一种化合物,该反应的化学方程式为
您最近一年使用:0次
10 . 如图是元素周期表的一部分。回答下列问题:
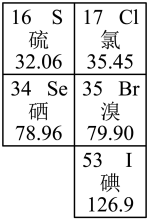
(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①溴在元素周期表中的位置_______ 。
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。
③类卤素IBr有很多类似于卤素单质的性质,已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式_______ 。IBr中含有的化学键是_______ (填“离子键”、“极性键”或“非极性键”)。
(2)硒能够增强人体免疫力,是人体必需的微量元素。
① 的离子结构示意图为
的离子结构示意图为_______ 。
② 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成Se和
气体发生反应,生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式_______ 。
(3)下列说法正确的是_______ (填字母)。
a.原子半径: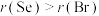
b.非金属性:
c.气态氢化物稳定性: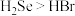

(1)地球上99%的溴元素存在于海水中,因此溴被称为“海洋元素”。
①溴在元素周期表中的位置
②表中与溴同主族的元素中,最高价氧化物对应的水化物酸性最强的是
③类卤素IBr有很多类似于卤素单质的性质,已知IBr能与水发生非氧化还原反应,写出IBr与水反应的化学方程式
(2)硒能够增强人体免疫力,是人体必需的微量元素。
①
 的离子结构示意图为
的离子结构示意图为②
 溶于水生成
溶于水生成 ,向所得溶液中通入
,向所得溶液中通入 气体发生反应,生成Se和
气体发生反应,生成Se和 。写出
。写出 与
与 反应的化学方程式
反应的化学方程式(3)下列说法正确的是
a.原子半径:
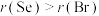
b.非金属性:

c.气态氢化物稳定性:
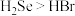
您最近一年使用:0次



