名校
1 . 回答下列问题。
(1)第117号元素Ts在周期表中的位置是___________ 。
(2)下图表示铷(Rb)及其化合物的产业链,回答相应问题。___________ (填“小于”或“大于”)钾的离子半径。
②写出由氧化铷制备氢氧化铷的化学方程式___________ 。
③离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是___________ 。
(3)阅读短文,回答问题。
硅元素在地壳中的含量仅次于氧。人类很早就利用硅酸盐烧陶制瓷、获得玻璃制品。
1824年,人类成功提炼出硅单质。由石英砂制高纯硅的过程如下:
整个芯片制造过程需要许多高精密度的专业设备,其中不乏我国目前还未完全掌握而被“卡脖子”的技术。我国科学家正开发“碳基”芯片来替代硅基芯片,习近平主席评价此项研究“另辟蹊径,柳暗花明”。
①请依据以上短文,下列说法正确是___________ 。
A.硅元素在自然界中以游离态(单质)形式存在,石英砂的主要成分是SiO2
B.单晶硅做芯片的基底材料与硅元素储量丰富,单晶硅导电性好、耐腐蚀性能优异有关
C.制备单质硅的过程中焦炭过多容易生成副产物金刚砂
D.碳和硅在周期表中位于同一主族,性质相似,因此“碳基”芯片有望替代硅基芯片
②制备高纯硅过程必须严格控制无水无氧,因为SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式___________ 。
③有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似,化学性质活泼,可在空气中自燃,写出乙硅烷在空气中自燃的化学方程式___________ 。
(1)第117号元素Ts在周期表中的位置是
(2)下图表示铷(Rb)及其化合物的产业链,回答相应问题。
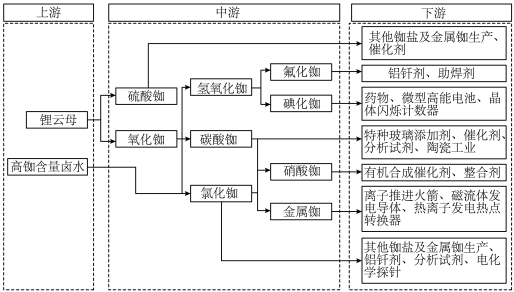
②写出由氧化铷制备氢氧化铷的化学方程式
③离子推进火箭是通过电离原子气体,转化为阳离子,然后离子被电场力作用加速,通过排气口射出推进器,产生反作用力推动火箭。单质铷适合用于离子推进火箭的原因是
(3)阅读短文,回答问题。
硅元素在地壳中的含量仅次于氧。人类很早就利用硅酸盐烧陶制瓷、获得玻璃制品。
1824年,人类成功提炼出硅单质。由石英砂制高纯硅的过程如下:
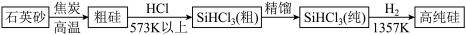
整个芯片制造过程需要许多高精密度的专业设备,其中不乏我国目前还未完全掌握而被“卡脖子”的技术。我国科学家正开发“碳基”芯片来替代硅基芯片,习近平主席评价此项研究“另辟蹊径,柳暗花明”。
①请依据以上短文,下列说法正确是
A.硅元素在自然界中以游离态(单质)形式存在,石英砂的主要成分是SiO2
B.单晶硅做芯片的基底材料与硅元素储量丰富,单晶硅导电性好、耐腐蚀性能优异有关
C.制备单质硅的过程中焦炭过多容易生成副产物金刚砂
D.碳和硅在周期表中位于同一主族,性质相似,因此“碳基”芯片有望替代硅基芯片
②制备高纯硅过程必须严格控制无水无氧,因为SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出该反应的化学方程式
③有一类组成最简单的有机硅化合物叫硅烷,硅烷的组成、结构与相应的烷烃相似,化学性质活泼,可在空气中自燃,写出乙硅烷在空气中自燃的化学方程式
您最近一年使用:0次
名校
2 . Fe元素在元素周期表中的位置___________ 。
您最近一年使用:0次
3 . X、Y、Z、W、M、R、T七种短周期元素,周期表中位置如图:
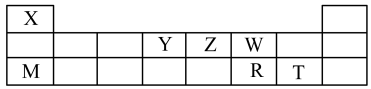
试回答下列问题:
(1)X、Z、W三种元素的原子半径由大到小的排列顺序是______ (用元素符号表示)。
(2)W的简单氢化物的电子式为_______ 。
(3)由X、Z、W三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为______ 。
(4)R、T两种元素简单氢化物的稳定性由强到弱的的顺序是______ (用化学式表示)。
(5)M和R最高价氧化物对应水化物反应的离子方程式为______ 。

试回答下列问题:
(1)X、Z、W三种元素的原子半径由大到小的排列顺序是
(2)W的简单氢化物的电子式为
(3)由X、Z、W三种元素可组成一种强酸,该强酸的稀溶液能与铜反应,则该反应的化学方程式为
(4)R、T两种元素简单氢化物的稳定性由强到弱的的顺序是
(5)M和R最高价氧化物对应水化物反应的离子方程式为
您最近一年使用:0次
名校
4 . 现代化学在材料、资源、能源、环境、医药、信息技术等领域均有重大应用。
I.新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:
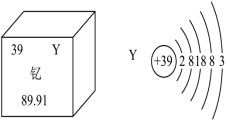
(1)钇原子核内有___________ 个质子,图中89.91表示的是___________ 。
(2)钇元素形成氧化物的化学式是___________ 。
II.电解质是维持人体生理活动的基础之一、请回答下列问题:
①CO2 ②Al ③乙醇 ④Fe(OH)3胶体 ⑤熔融BaSO4 ⑥KOH溶液 ⑦固态
(3)上述物质中属于电解质的是___________ 。(填序号)
(4)属于非电解质的是___________ 。(填序号)
(5)能导电的纯净物是___________ 。(填序号)
(6)写出⑦在水中的电离方程式___________ 。
(7)写出①和⑥的反应方程式___________ 。
(8)请写出实验室中制备Fe(OH)3胶体的化学反应方程式___________ 。
I.新疆也要建造磁悬浮列车了。在磁悬浮列车制造过程中将使用大量含钇(Y)元素的超导材料。钇(Y)元素在元素周期表中的信息如图所示:

(1)钇原子核内有
(2)钇元素形成氧化物的化学式是
II.电解质是维持人体生理活动的基础之一、请回答下列问题:
①CO2 ②Al ③乙醇 ④Fe(OH)3胶体 ⑤熔融BaSO4 ⑥KOH溶液 ⑦固态

(3)上述物质中属于电解质的是
(4)属于非电解质的是
(5)能导电的纯净物是
(6)写出⑦在水中的电离方程式
(7)写出①和⑥的反应方程式
(8)请写出实验室中制备Fe(OH)3胶体的化学反应方程式
您最近一年使用:0次
名校
5 . 航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料。
(1)写出高氯酸铵组成元素中,原子核外有三层电子的原子的结构示意图___________ 。
(2)高氯酸铵对应酸高氯酸HClO4的酸酐是___________ 。
(3)150℃时高氯酸铵发生分解反应:2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,其气态生成物组成的混合气的平均相对分子质量为___________ 。
(1)写出高氯酸铵组成元素中,原子核外有三层电子的原子的结构示意图
(2)高氯酸铵对应酸高氯酸HClO4的酸酐是
(3)150℃时高氯酸铵发生分解反应:2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,其气态生成物组成的混合气的平均相对分子质量为
您最近一年使用:0次
名校
6 . 肼(N2H4)是重要的化工原料,能与水、乙醇等混溶;它是一种二元弱碱,在水中的电离方式与氨相似,室温下电离常数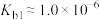 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。
(1)写出N元素在元素周期表中的位置___________ 。
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式___________ 。
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步: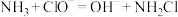
①写出第二步反应的离子方程式___________ 。
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)___________ 。
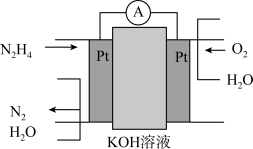
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为___________ 。
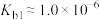 ;在碱性溶液中,N2H4是强还原剂。
;在碱性溶液中,N2H4是强还原剂。(1)写出N元素在元素周期表中的位置
(2)写出N2H4与过量硫酸反应形成的酸式盐的化学式
(3)N2H4可通过NH3和NaClO反应制得,总反应主要分为两步,
已知第一步:
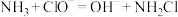
①写出第二步反应的离子方程式
②请设计实验,检验总反应中产物的主要阴离子(假设反应物完全反应)
(4)N2H4是一种高能燃料,可用于燃料电池,原理如图,电池的负极反应式为

您最近一年使用:0次
名校
7 . 近年来,我国航空航天事业成果显著,“北斗三号”导航卫星搭载了精密计时的铷(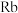 )原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
)原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
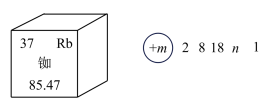
(1)下列说法错误的是_____(填字母)。
(2)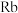 原子第一电子层上电子的能量比最外层上电子的能量
原子第一电子层上电子的能量比最外层上电子的能量_____ (填“低”或“高”)。
(3)如图2中A-E所示粒子共表示种元素;铷元素原子的化学性质与如图中_____ (填字母)的化学性质相似;属于阴离子结构示意图的是_____ (填字母);写出B与D形成化合物的化学式_____ 。
(4)在核电荷数1~10的元素内,列举两个与图2中E电子层结构相同的离子,写出离子的符号_____ 。
A.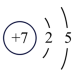 B.
B. C.
C. D.
D. E.
E.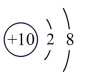
 )原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
)原子钟。如图为铷元素在元素周期表中的信息和铷的原子结构示意图(如图)。回答下列问题:
(1)下列说法错误的是_____(填字母)。
A. |
| B.铷是金属元素 |
| C.铷的相对原子质量是85.47 |
| D.铷原子有5个电子层,最外层有1个电子 |
(2)
 原子第一电子层上电子的能量比最外层上电子的能量
原子第一电子层上电子的能量比最外层上电子的能量(3)如图2中A-E所示粒子共表示种元素;铷元素原子的化学性质与如图中
(4)在核电荷数1~10的元素内,列举两个与图2中E电子层结构相同的离子,写出离子的符号
A.
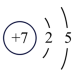 B.
B. C.
C. D.
D. E.
E.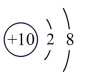
您最近一年使用:0次
名校
8 . 下表是某些短周期元素的电负性值:
(1)通过分析电负性值变化规律,确定 的电负性值范围:
的电负性值范围:_______ 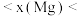
_______ 。
(2)推测 值与原子半径的关系是
值与原子半径的关系是_______ ;根据短周期元素的 值变化特点,体现了元素性质的
值变化特点,体现了元素性质的_______ 变化规律。
(3)分别指出下列两种化合物中氧元素的化合价:
_______ ,
_______ 。
(4)试推断 中化学键类型是
中化学键类型是_______ 。
(5)预测元素周期表中, 值最小的元素位于
值最小的元素位于_______ 周期_______ 族(放射性元素除外)。
| 元素符号 |  |  |  |  |  |  |  |  |  |  |  |  |
电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析电负性值变化规律,确定
 的电负性值范围:
的电负性值范围: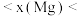
(2)推测
 值与原子半径的关系是
值与原子半径的关系是 值变化特点,体现了元素性质的
值变化特点,体现了元素性质的(3)分别指出下列两种化合物中氧元素的化合价:


(4)试推断
 中化学键类型是
中化学键类型是(5)预测元素周期表中,
 值最小的元素位于
值最小的元素位于
您最近一年使用:0次
名校
9 . 我国的“天宫”空间站的核心舱“天和”选择了高效柔性砷化镓(GaAs)薄膜太阳能电池来供电。
(1)镓的原子结构示意图为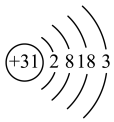 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是___________ 。
(2)GaAs的熔点为1238℃且熔融状态不导电,据此判断它是___________ (填“共价”或“离子”)化合物。
(3)镓与氨气在1100℃下反应生成氮化镓和氢气,该可逆反应每生成1 mol 放出10.3 kJ热量。该反应的热化学方程式是
放出10.3 kJ热量。该反应的热化学方程式是___________ 。(已知金属镓的熔点是29.8℃,沸点是2403℃;氮化镓的熔点为1700℃)
(4)下列说法错误的是___________ 。
a.氢氧化镓可能具有两性 b.砷化镓具有半导体性质
c.As与 在低温时可剧烈化合为
在低温时可剧烈化合为 d.酸性:
d.酸性:
(1)镓的原子结构示意图为
 ,镓元素在元素周期表中的位置是
,镓元素在元素周期表中的位置是(2)GaAs的熔点为1238℃且熔融状态不导电,据此判断它是
(3)镓与氨气在1100℃下反应生成氮化镓和氢气,该可逆反应每生成1 mol
 放出10.3 kJ热量。该反应的热化学方程式是
放出10.3 kJ热量。该反应的热化学方程式是(4)下列说法错误的是
a.氢氧化镓可能具有两性 b.砷化镓具有半导体性质
c.As与
 在低温时可剧烈化合为
在低温时可剧烈化合为 d.酸性:
d.酸性:
您最近一年使用:0次
10 . 人体必需的一些元素在周期表中的分布情况如下:

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是___________ ,原子序数为___________ 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
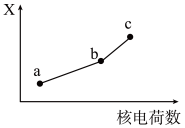
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________(填字母)。

| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
2023-12-05更新
|
264次组卷
|
3卷引用:湖北省宜城市第一中学等六校2023-2024学年高二上学期期中考试化学试题



