名校
1 . Ⅰ.黑火药爆炸的化学方程式为: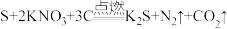 。回答下列问题:
。回答下列问题:
(1)硫元素在周期表的位置是_______ 。氨气的电子式_______ 。
(2)用电子式表示化合物 的形成过程为
的形成过程为_______ 。
(3)上述氧化产物结构式为_______ 。
(4)硫、氮及其化合物中,下列比较正确的是_______(选填编号)。
Ⅱ.如图列出了①~⑩十种元素在周期表中的位置:
请回答下列问题:
(5)上述元素中,M层电子数最多的是_______ (填元素名称)。
(6)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是_______ (用离子符号表示)。
(7)下列可以比较⑤、⑥两元素金属性强弱的实验是_______(填字母)。
(8)元素⑦的最高价氧化物对应的水化物与元素⑨的最简单氢化物的水溶液反应的离子方程式_______ 。
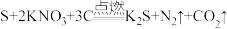 。回答下列问题:
。回答下列问题:(1)硫元素在周期表的位置是
(2)用电子式表示化合物
 的形成过程为
的形成过程为(3)上述氧化产物结构式为
(4)硫、氮及其化合物中,下列比较正确的是_______(选填编号)。
A.原子半径: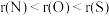 | B.热稳定性: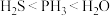 |
C.溶解度: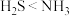 | D.微粒种类:氢硫酸<氨水 |
Ⅱ.如图列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
请回答下列问题:
(5)上述元素中,M层电子数最多的是
(6)由④、⑤、⑦、⑧四种元素形成的简单离子半径由大到小的顺序是
(7)下列可以比较⑤、⑥两元素金属性强弱的实验是_______(填字母)。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将⑤的单质投入到⑥的盐溶液中 |
| C.将形状、大小相同的这两种元素的单质分别与等体积20℃的水反应 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
您最近一年使用:0次
名校
2 . 随着原子序数的递增,七种短周期元素的原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。请回答下列问题:
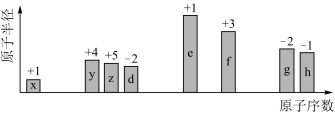
(1)x在元素周期表中的位置是___________ ,如果x的某种原子中含2个中子,则该原子的核素符号为___________ 。
(2)y的最简单氢化物中含有的化学键类型为___________ (填“离子键”“极性共价键”或“非极性共价键”)。
(3)d、e、f的简单离子半径由大到小的顺序为___________ (用离子符号表示)。
(4) e的单质在空气中充分燃烧,所得产物的电子式为___________ 。
(5)f的单质和e的最高价氧化物对应的水化物相互反应的化学方程式为___________ 。
(6)能说明h的非金属性比g的强的实验事实是___________ (列举一条)。

(1)x在元素周期表中的位置是
(2)y的最简单氢化物中含有的化学键类型为
(3)d、e、f的简单离子半径由大到小的顺序为
(4) e的单质在空气中充分燃烧,所得产物的电子式为
(5)f的单质和e的最高价氧化物对应的水化物相互反应的化学方程式为
(6)能说明h的非金属性比g的强的实验事实是
您最近一年使用:0次
名校
3 . 下表是周期表中的一部分,根据①—⑧在周期表中的位置,用元素符号或化学式回答问题
(1)画出表中元素中,非金属性最强的元素的离子结构示意图_______ ;
(2)这些元素的最高价氧化物对应水化物中酸性最强的是______ ,碱性最强的是______ ;
(3)用电子式表示表中④和⑥两元素以1:2微粒个数比形成化合物的过程_______ ;
(4)表中⑤⑦两种元素氢化物的稳定性更强的是_______ ;
(5)⑥和⑧两种元素形成的氯化物的熔点较高的是_______ ,简述判断理由_______ ;
(6)用一个化学方程式证明②③两种元素非金属性的强弱_______ 。

(1)画出表中元素中,非金属性最强的元素的离子结构示意图
(2)这些元素的最高价氧化物对应水化物中酸性最强的是
(3)用电子式表示表中④和⑥两元素以1:2微粒个数比形成化合物的过程
(4)表中⑤⑦两种元素氢化物的稳定性更强的是
(5)⑥和⑧两种元素形成的氯化物的熔点较高的是
(6)用一个化学方程式证明②③两种元素非金属性的强弱
您最近一年使用:0次
4 . 下表列出了A- H8种元素在周期表中的位置(填元素符号) :
这8种元素分别为A______ ,B________ , C_______ ,D_______ , E_____ ,F___________ , G_______ H______ 。其中化学性质最不活泼的是_____ 。
| 族 周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | H | |||
| 4 | B |
您最近一年使用:0次
名校
解题方法
5 . 下表是元素周期表的一部分。表中所列的字母分别代表一种元素。
回答下列问题:
(1)D的简单气态氢化物分子的立体构型为___________ 。
(2)第一电离能H___________ X(填“>”、“<”或“=”)。
(3)DA3的沸点比D2E的沸点高,其原因是___________ 。
(4)YE 的立体构型为
的立体构型为___________ ,YE 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是___________ 。
| A | R | ||||||||||||||||
| B | D | E | M | T | |||||||||||||
| G | H | X | J | Y | L | ||||||||||||
| N |
(1)D的简单气态氢化物分子的立体构型为
(2)第一电离能H
(3)DA3的沸点比D2E的沸点高,其原因是
(4)YE
 的立体构型为
的立体构型为 的键角比YE
的键角比YE 的键角小的原因是
的键角小的原因是
您最近一年使用:0次
2022-05-05更新
|
103次组卷
|
2卷引用:陕西省西安中学2021-2022学年高二下学期期中考试化学试题
名校
6 . C、Si是构成无机非金属材料的重要元素。
(1)Si在周期表中的位置为_______ 。
(2)为比较C、Si的非金属性,某同学设计了如下实验:
资料:硅酸(H2SiO3)是难溶于水的白色胶状沉淀

装置①中盛放的试剂是_______ ,理论预测装置②中能发生反应的离子方程式是_______ 。
(3)SiC是一种重要的高温耐磨材料。SiC中,C元素显_______ (填“正”或“负”)化合价
(1)Si在周期表中的位置为
(2)为比较C、Si的非金属性,某同学设计了如下实验:
资料:硅酸(H2SiO3)是难溶于水的白色胶状沉淀

装置①中盛放的试剂是
(3)SiC是一种重要的高温耐磨材料。SiC中,C元素显
您最近一年使用:0次
7 . 短周期元素A、B、D、E、G、J在周期表中的位置如下:
根据上表回答问题:
(1)D在周期表中的位置是_______ 。
(2)A、B、E、G的原子半径由大到小的顺序是_______ (填元素符号)。
(3)B、D的气态氢化物的稳定性关系为_______ (填化学式)。
(4)用电子式表示A与J形成化合物的过程:_______ 。
(5)34Se与D同主族,其非金属性比D_______ (填“强”或“弱”),从原子结构的角度解释其原因_______ 。
(6)E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为:
①H++OH-=H2O;
②_______ ;
③_______ 。
(7)A和B可以形成多种化合物,下图模型表示的分子中,不可能由A和B形成的是_______ (填序号)。
a.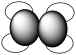 b.
b.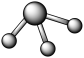 c.
c.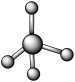 d.
d.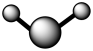
| A | |||||||
| B | D | ||||||
| E | G | J |
根据上表回答问题:
(1)D在周期表中的位置是
(2)A、B、E、G的原子半径由大到小的顺序是
(3)B、D的气态氢化物的稳定性关系为
(4)用电子式表示A与J形成化合物的过程:
(5)34Se与D同主族,其非金属性比D
(6)E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为:
①H++OH-=H2O;
②
③
(7)A和B可以形成多种化合物,下图模型表示的分子中,不可能由A和B形成的是
a.
 b.
b. c.
c. d.
d.
您最近一年使用:0次
8 . I.如图为元素周期表的一部分,请回答下列问题。

(1)图中阴影部分所示区域的元素称为_______ 元素,下列元素属于该区域的是_______ 。
A.Ba B.Mn C.I D.Rb
(2)下列说法不正确的是_______;
II.已知A、B、C、D、E、F六种短周期元素的原子半径和主要化合价如表:
(3)写出C元素在元素周期表中的位置_______ ;
(4)E和F的最高价氧化物的水化物相互反应的离子方程式为_______ ;
(5)以上元素的单质中还原性最强的是_______ (填化学式);
(6)上述某种元素其最高价氧化物的水化物与其气态氢化物相互反应的化学方程式_______ 。

(1)图中阴影部分所示区域的元素称为
A.Ba B.Mn C.I D.Rb
(2)下列说法不正确的是_______;
| A.最高正价与最低负价绝对值相等的元素一定处于IVA族 |
| B.图中①形成的最高价氧化物的水化物比③形成的最高价氧化物的水化物碱性强 |
| C.图中②的单质可与冷水剧烈反应 |
| D.同周期相邻主族元素的原子序数可能相差1、11或25 |
II.已知A、B、C、D、E、F六种短周期元素的原子半径和主要化合价如表:
| 元素代号 | A | B | C | D | E | F |
| 原子半径/nm | 0.074 | 0.075 | 0.077 | 0.160 | 0.186 | 0.143 |
| 主要化合价 |  |  、 、 |  、 、 |  |  |  |
(4)E和F的最高价氧化物的水化物相互反应的离子方程式为
(5)以上元素的单质中还原性最强的是
(6)上述某种元素其最高价氧化物的水化物与其气态氢化物相互反应的化学方程式
您最近一年使用:0次
名校
9 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。如图是元素周期表的一部分,回答下列问题。
(1)周期表呈现的短周期元素中,次外层电子数等于其他电子层电子数之和的元素是_______ (写原子结构示意图);上述周期表呈现的元素中,金属性最强的元素在周期表中处于第_______ 周期第_______ 族 ,非金属性最强的元素是:_______ (写电子式)。
(2)Sn的最高正价为_______ ,写 出Cl的最高价氧化物对应水化物的化学式_______ 。
(3)比较微粒半径大小: Al_______ F; Al3+_______ F-。(选填“>”或“<”)
(4)元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。
①以下关于碱金属,说法不正确的是_______ 。
A.随电子层数增多,原子半径逐渐增大
B.随着核电荷数的增加,离子的氧化性逐渐增强
C.钾与氧气或水反应比钠的反应剧烈,也比铷、铯的反应更剧烈
D.原子易失去电子,呈现+1价
②硅元素存在多种同位素。已知三种天然稳定同位素的数据如下:
请列出硅元素的近似相对原子质量的计算式_______ 。
③原子数相同,电子总数相同的粒子互称为等电子体。Y、Q是上述周期表中短周期元素,元素相关信息如见表。
硼元素与Y、Q形成互为等电子体负离子: BY 、BQ
、BQ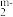 , 则m值为
, 则m值为_______ 。
| B | C | N | O | F |
| Al | Si | P | S | Cl |
| Ga | Ge | As | Se | Br |
| In | Sn | Sb | Te | I |
(2)Sn的最高正价为
(3)比较微粒半径大小: Al
(4)元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。
①以下关于碱金属,说法不正确的是
A.随电子层数增多,原子半径逐渐增大
B.随着核电荷数的增加,离子的氧化性逐渐增强
C.钾与氧气或水反应比钠的反应剧烈,也比铷、铯的反应更剧烈
D.原子易失去电子,呈现+1价
②硅元素存在多种同位素。已知三种天然稳定同位素的数据如下:
| 核素符号 | 28Si | 29Si | 30Si |
| 相对原子质量 | 27.977 | 28.976 | 29.974 |
| 丰度 | 92.2% | 4.7% | 3.1% |
③原子数相同,电子总数相同的粒子互称为等电子体。Y、Q是上述周期表中短周期元素,元素相关信息如见表。
| Q | 与H可形成QH3的10电子结构分子 |
| Y | 带两个负电荷的负离子与氖原子结构相同 |
 、BQ
、BQ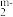 , 则m值为
, 则m值为
您最近一年使用:0次
10 . 铅的合金可作轴承、电缆外皮之用,还可做体育器材铅球等。
(1)铅元素位于元素周期表第六周期IVA族,该族中原子序数最小的元素的原子有_______ 种 能量不同的电子,其次外层的电子云有_______ 种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是_______ (填化学式),气态氢化物沸点最低的是_______ (填电子式)。
(3)配平下列化学方程式,把系数以及相关物质填写在空格上,并标出电子转移的方向和数目______ 。
_______PbO2+_______MnSO4+______HNO3→_______HMnO4+______Pb(NO3)2+_______PbSO4↓+_______
(4)把上述反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol·L-1,则反应中转移的电子数为_______ 个,该反应中被氧化的元素是_______ 。 若将该反应设计成一原电池,则_______ 极 (填电极名称)附近溶液出现紫红色。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______。
(6)已知如下热化学方程式:
Ca(s)+Cl2(g)→CaCl2(s)+ 795kJ
Sr(s)+Cl2(g)→SrCl2(s) + 828kJ
Ba(s)+ Cl2(g) → BaCl2(s) + 860kJ
则①CaCl2、②SrCl2、③BaCl2三种氯化物的稳定性由大到小的排列为_______ (填序号)。从能量的角度解释理由是_______ 。
(1)铅元素位于元素周期表第六周期IVA族,该族中原子序数最小的元素的原子有
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是
(3)配平下列化学方程式,把系数以及相关物质填写在空格上,并标出电子转移的方向和数目
_______PbO2+_______MnSO4+______HNO3→_______HMnO4+______Pb(NO3)2+_______PbSO4↓+_______
(4)把上述反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol·L-1,则反应中转移的电子数为
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______。
| A.PbO2+4HCl →PbCl4+2H2O | B.PbO2+4HCl →PbCl2+ Cl2↑+2H2O |
| C.PbO2+2HCl+2H+→PbCl2+2H2O | D.PbO2+4HCl→PbCl2+2OH- |
Ca(s)+Cl2(g)→CaCl2(s)+ 795kJ
Sr(s)+Cl2(g)→SrCl2(s) + 828kJ
Ba(s)+ Cl2(g) → BaCl2(s) + 860kJ
则①CaCl2、②SrCl2、③BaCl2三种氯化物的稳定性由大到小的排列为
您最近一年使用:0次



