名校
解题方法
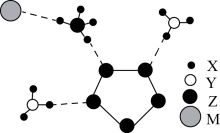
1 . 南京理工大学合成的一种离子化合物的局部结构如图所示,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子.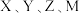 均为短周期元素,且均不在同一族.回答下列问题:
均为短周期元素,且均不在同一族.回答下列问题:
(1)M元素在元素周期表中的位置为______________ .
(2)该化合物中存在的化学键类型有______________ .
(3)该化合物中的两种10电子离子是______________ (填离子符号,下同),18电子离子是______________ .
(4) 形成的一种化合物具有很强的漂白性,写出它的电子式:
形成的一种化合物具有很强的漂白性,写出它的电子式:______________ .
(5) 和
和 的稳定性相对较强的是
的稳定性相对较强的是______________ (填化学式).
(6)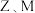 两元素的最高价氧化物对应水化物的酸性由强到弱的顺序是
两元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______________ (用化学式表示).
(7) 和
和 在催化剂作用下可以反应生成
在催化剂作用下可以反应生成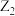 和
和 ,写出该反应的化学方程式,并用单线桥法表示电子转移的方向和数目:
,写出该反应的化学方程式,并用单线桥法表示电子转移的方向和数目:____________________________ .
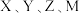 均为短周期元素,且均不在同一族.回答下列问题:
均为短周期元素,且均不在同一族.回答下列问题:
(1)M元素在元素周期表中的位置为
(2)该化合物中存在的化学键类型有
(3)该化合物中的两种10电子离子是
(4)
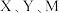 形成的一种化合物具有很强的漂白性,写出它的电子式:
形成的一种化合物具有很强的漂白性,写出它的电子式:(5)
 和
和 的稳定性相对较强的是
的稳定性相对较强的是(6)
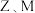 两元素的最高价氧化物对应水化物的酸性由强到弱的顺序是
两元素的最高价氧化物对应水化物的酸性由强到弱的顺序是(7)
 和
和 在催化剂作用下可以反应生成
在催化剂作用下可以反应生成 和
和 ,写出该反应的化学方程式,并用单线桥法表示电子转移的方向和数目:
,写出该反应的化学方程式,并用单线桥法表示电子转移的方向和数目:
您最近一年使用:0次
2024-02-02更新
|
193次组卷
|
2卷引用:山西省晋中市2023-2024学年高一上学期1月期末考试化学试题
解题方法
2 . 有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题:
(1)D基态原子中能量最高的电子其原子轨道呈______ 形。
(2)G位于元素周期表的位置为:____________ ,位于______ 区,价电子排布式为______ 。
(3)写出由A、B、E三种元素形成的离子化合物的电子式____________ 。
(4)检验F元素的方法是____________ ,请用原子结构的知识解释产生此现象的原因是________________________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1个 |
C元素原子的第一至第四电离能分别是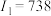 kJ·mol kJ·mol ; ;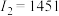 kJ·mol kJ·mol ; ;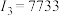 kJ·mol kJ·mol ; ;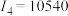 kJ·mol kJ·mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)G位于元素周期表的位置为:
(3)写出由A、B、E三种元素形成的离子化合物的电子式
(4)检验F元素的方法是
您最近一年使用:0次
名校
3 . 短周期元素X、Y、Z、W、R的原子序数依次增大,Y与W同主族,Z与R同主族,它们形成的甲、乙两种物质(如图所示)是有机合成中常用的还原剂。下列说法正确的是
甲: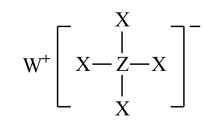 乙:
乙: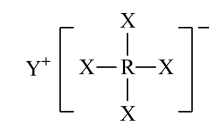
甲:
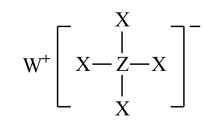 乙:
乙: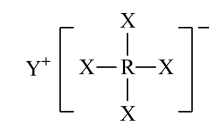
| A.电负性:X>R>Z |
| B.W形成的过氧化物在工业上常用做消毒剂 |
| C.单质Y和W在空气中燃烧的产物所含化学键类型完全相同 |
| D.甲、乙两化合物中的元素都满足8电子稳定结构 |
您最近一年使用:0次
2022-09-18更新
|
266次组卷
|
2卷引用:山西省榆次第一中学校 2022-2023学年高三上学期10 月模拟考试化学试题
4 . X、Y 、Z、M是四种短周期主族元素,它们组成一种团簇分子X2Z2Y4(YM)2,其结构如图所示(球的大小表示原子半径的相对大小)。其中X与Y原子核外电子总数之比为3:2,M的原子序数小于Y,Z是一种金属元素。下列说法错误的是


| A.简单离子半径:X>Z> Y> M |
| B.最高价氧化物对应水化物的碱性:X>Z |
| C.Y和M形成的化合物可能含有非极性键 |
| D.可通过电解Y、Z形成的化合物的熔融态制备Z单质 |
您最近一年使用:0次
5 . 下表为元素周期表的一部分,表中的一个序号代表一种元素。某种融雪剂在机场、高速公路等地被广泛使用,该融雪剂的主要成分是由下表中部分元素(①~①)组成的化合物A(化学式为 )。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。
)。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。
(1)A的化学式为___________ ,该化合物中存在的化学键类型有___________ ;元素M在周期表中位置为___________ 。
(2)X、Z和③的原子半径由大到小的顺序为___________ (用元素符号表示)。
(3)⑥的单质在④的单质中燃烧的现象为___________ ,生成物的电子式为___________ 。
(4)⑥⑦①三种元素的氢氧化物,碱性由强到弱的顺序为___________ (填化学式)。
(5)元素⑨的单质和元素⑩的最高价氧化物的水化物反应的离子方程式为___________ 。
(6)我们可以利用如图装置通过实验比较元素②和⑧的非金属性强弱;从下列选项中选出实验所需的物质(已知: 不溶于水):
不溶于水):
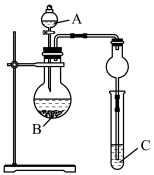
a.稀盐酸 b.稀硫酸
c.碳酸钙 d. 溶液
溶液
试剂A为___________ (填字母,下同);试剂C为___________ 。请指出该装置存在的一个缺陷:___________ 。
 )。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。
)。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。| 族 周期 | Ⅰ A | 0 | |||||||
| 1 | ① | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | ||
| 2 | ② | ③ | ④ | ⑤ | |||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
| 4 | ⑩ | ||||||||
(2)X、Z和③的原子半径由大到小的顺序为
(3)⑥的单质在④的单质中燃烧的现象为
(4)⑥⑦①三种元素的氢氧化物,碱性由强到弱的顺序为
(5)元素⑨的单质和元素⑩的最高价氧化物的水化物反应的离子方程式为
(6)我们可以利用如图装置通过实验比较元素②和⑧的非金属性强弱;从下列选项中选出实验所需的物质(已知:
 不溶于水):
不溶于水):
a.稀盐酸 b.稀硫酸
c.碳酸钙 d.
 溶液
溶液试剂A为
您最近一年使用:0次
解题方法
6 . A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。
(1)C的原子的价电子排布式为___________ 。
(2)在B的单质分子中存在___________ 个π键,___________ 个σ键。
(3)已知B的气态氢化物很容易与H+结合,B的气态氢化物分子与 H+形成的离子立体构型为___________ 。
(4)在A、B、C、D四种元素形成的电子数相同的四种氢化物中沸点最低的是___________ (写分子式),其沸点显著低于其他三种氢化物的原因是: ___________ 。
(1)C的原子的价电子排布式为
(2)在B的单质分子中存在
(3)已知B的气态氢化物很容易与H+结合,B的气态氢化物分子与 H+形成的离子立体构型为
(4)在A、B、C、D四种元素形成的电子数相同的四种氢化物中沸点最低的是
您最近一年使用:0次
7 . 根据下列叙述完成要求
(1)A元素原子核外M层电子数是L层电子数的一半___________ (写出元素名称);
(2)B元素原子的最外层电子数是次外层电子数的1.5倍___________ (画出原子结构示意图);
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃:___________ (写出核外电子排布式);
(4)D元素的次外层电子数是最外层电子数的 :
: ___________ (写出价电子排布式);
(5)1~36号元素原子核外电子排布中未成对电子数最多的原子___________ (价电子排布图)。
(1)A元素原子核外M层电子数是L层电子数的一半
(2)B元素原子的最外层电子数是次外层电子数的1.5倍
(3)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃:
(4)D元素的次外层电子数是最外层电子数的
 :
: (5)1~36号元素原子核外电子排布中未成对电子数最多的原子
您最近一年使用:0次
名校
解题方法
8 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X、Z的原子最外层电子数之和为5;W与Y同族;X是形成化合物种类最多的元素,W的单质为常见气体,其水溶液具有漂白性。下列说法正确的是
| A.Y的最高正化合价为+7 |
| B.元素X的氢化物中,各原子均满足8电子的稳定结构 |
| C.Z的氧化物中阴阳离子个数比为1:2 |
| D.W的单质与过量的铁反应产物为FeW2 |
您最近一年使用:0次
2020-07-14更新
|
204次组卷
|
4卷引用:山西省晋中市祁县第二中学2019-2020学年高一下学期期末考试化学试题
山西省晋中市祁县第二中学2019-2020学年高一下学期期末考试化学试题山东省菏泽市第一中学2019-2020学年高一下学期期末模拟化学试题(已下线)第五单元 元素周期表和元素周期律测试题-2021年高考化学一轮复习名师精讲练山西省朔州市怀仁县大地学校2019-2020学年高二上学期第一次月考化学试题
名校
解题方法
9 . W、X、Y、Z是原子序数依次增大的四种短周期元素。n、p、r是由这些元素组成的二元化合物。m 是元素W的单质。q是元素Y的单质且是制作太阳能电池的原料。p在常温下为常见无色液体,0.010mol·L-1的r溶液中c(H+)为0.010 mol·L-1,s是弱酸且不溶于水。上述物质的转化关系如图所示。下列说法不正确的是


| A.r易溶于p |
| B.原子半径:Z<Y |
| C.最高价氧化物对应水化物的酸性:Y<Z |
| D.最简单氢化物的稳定性:X<Y |
您最近一年使用:0次
2020-04-29更新
|
382次组卷
|
2卷引用:山西省晋中市和诚中学2019-2020学年高一4月月考化学试题
解题方法
10 . A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)A的元素符号______________ ,D的元素名称 ____________ 。
(2)C在周期表中的位置:___________ ,E的离子结构示意图________ ;
(3)B、C、E分别与A形成的化合物中最稳定的是________ (写化学式);E、F的最高价氧化物对应的水化物的酸性较强的是________ (写化学式)
(4)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为________________ 。
(5)X在纯净的C单质中可以安静的燃烧,生成B的单质。该反应的化学方程式为:__________________ 。
(1)A的元素符号
(2)C在周期表中的位置:
(3)B、C、E分别与A形成的化合物中最稳定的是
(4)F的单质在反应中常作氧化剂,该单质的水溶液与E的低价氧化物反应的离子方程式为
(5)X在纯净的C单质中可以安静的燃烧,生成B的单质。该反应的化学方程式为:
您最近一年使用:0次



