名校
解题方法
1 . 现有H、N、O、Na、S、Cl、Fe、Cu八种常见元素,回答下列问题:
(1)S在周期表中的位置____________ ;
(2)Na+ 离子的结构示意图为__________________ ;
(3)能说明非金属性Cl比S强的事实是_____________ (用化学方程式表示);
(4)物质A~L是由上述八种元素中的一种、二种或三种组成,A的摩尔质量166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E都为氢氧化物,E呈红褐色。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。它们有如图所示的关系(部分反应条件及产物已略去):
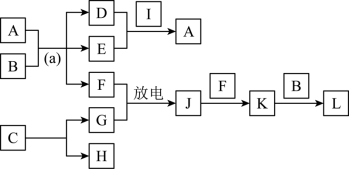
①C的化学式为____________________ ;
②D的电子式为____________________ ;
③L的稀溶液与H反应的离子方程式为___________________________________________ ;
④反应(a)的化学方程式为_________________________________________ 。
(1)S在周期表中的位置
(2)Na+ 离子的结构示意图为
(3)能说明非金属性Cl比S强的事实是
(4)物质A~L是由上述八种元素中的一种、二种或三种组成,A的摩尔质量166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E都为氢氧化物,E呈红褐色。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。它们有如图所示的关系(部分反应条件及产物已略去):

①C的化学式为
②D的电子式为
③L的稀溶液与H反应的离子方程式为
④反应(a)的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 短周期主族元素X、Y、Z、G、T的原子序数依次增大,Z、G是金属元素且G的氧化物属于两性氧化物,T的原子序数是Y的2倍且T、Y的最低化合价相同。这5种元素的价电子数之和等于20,含Z元素的物质的焰色呈黄色。回答下列问题:
(1)X的最高价氧化物对应水化物的化学式为___________ 。位于元素周期表中s区的元素为___________ (填元素符号)。
(2)Y、Z、G、T的电负性由小到大的顺序为___________ (填元素符号)。
(3) 分子是
分子是___________ (填“极性”或“非极性”)分子。 分子中T的价层电子对数为
分子中T的价层电子对数为___________ 。
(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为___________ 。
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型___________ 。
(6)T的一种单质的结构如图所示: ,T原子杂化类型是
,T原子杂化类型是________ 。32gT的这种单质含σ键的数目为________ 。这种单质易溶于 ,不溶于水,其原因是
,不溶于水,其原因是_________ 。
(1)X的最高价氧化物对应水化物的化学式为
(2)Y、Z、G、T的电负性由小到大的顺序为
(3)
 分子是
分子是 分子中T的价层电子对数为
分子中T的价层电子对数为(4)Y和Z能形成既含离子键,又含共价键的化合物,其化学式为
(5)V是由Y、Z、T组成的化合物,V的水溶液呈中性。则V的阴离子的空间构型
(6)T的一种单质的结构如图所示:
 ,T原子杂化类型是
,T原子杂化类型是 ,不溶于水,其原因是
,不溶于水,其原因是
您最近一年使用:0次
2023-04-28更新
|
178次组卷
|
3卷引用:江西省南昌市等5地2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
3 . W、X、Y、Z、M、G、H七种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、G同主族,可形成GY2、GY3两种分子;X的气态氢化物与其最高价氧化物的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
(1)Y在元素周期表中的位置为_______ 。
(2)Y、Z、G三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)上述元素的最高价氧化物对应水化物的碱性最强的是_______ (填化学式),Z、M最高价氧化物对应的水化物相互反应的离子方程式为_______ ,X的气态氢化物的催化氧化反应的化学方程式为_______ 。
(4)G的非金属性_______ (填“>”或“<”)H的非金属性,下列表述可以作为验证的证据的是_______ (填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、FeH3
D.比较这两种元素单质与酸或碱反应的难易程度
(1)Y在元素周期表中的位置为
(2)Y、Z、G三种元素原子半径由大到小的顺序是
(3)上述元素的最高价氧化物对应水化物的碱性最强的是
(4)G的非金属性
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、FeH3
D.比较这两种元素单质与酸或碱反应的难易程度
您最近一年使用:0次
2023-04-27更新
|
432次组卷
|
2卷引用:广西示范性高中2022-2023学年高一下学期4月期中联合调研测试化学试题
名校
解题方法
4 . X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由X、Z、Q三种元素组成。Q是短周期中金属性最强的元素,W与Z同主族。请回答下列问题:
(1)W在周期表中的位置为_____ ,R的离子结构示意图为_____ ,Q2Z2的电子式为_____ ,化合物甲中含有的化学键为_____ 。
(2)Y元素是自然界各种生物体生命活动不可缺少的重要元素,其气态氢化物丙与最高价氧化物对应水化物丁能发生化合反应,则Y元素为_____ (填元素符号),过量铁粉与丁的稀溶液反应的离子方程式为____ ,丙与NO在一定条件下能反应生成无毒无污染的物质,该反应的化学方程式为_____ 。
(3)化合物W2R2(沸点:138℃)可与水反应生成一种能使品红溶液褪色的气体,0.1mol该物质参加反应时转移0.15mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为_____ 。
(1)W在周期表中的位置为
(2)Y元素是自然界各种生物体生命活动不可缺少的重要元素,其气态氢化物丙与最高价氧化物对应水化物丁能发生化合反应,则Y元素为
(3)化合物W2R2(沸点:138℃)可与水反应生成一种能使品红溶液褪色的气体,0.1mol该物质参加反应时转移0.15mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为
您最近一年使用:0次
解题方法
5 . 甲是一种含结晶水的盐,由A、B、C、D、E五种原子序数依次增大的短周期元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。B元素原子核内质子数比C的少1,C、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,无现象。再加入BaCl2溶液,出现白色沉淀。
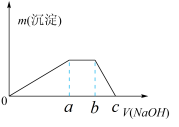
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示。
(1)D的元素符号是___________ E在周期表中的位置是___________ 。
(2)B、C、E的简单气态氢化物的沸点高低顺序为___________ (用化学式表示,下同);相同条件下,等物质的量浓度的B和E的最高价氧化物对应的水化物的水溶液,pH较小的是___________ 。
(3)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比为 ,则甲晶体的化学式为
,则甲晶体的化学式为___________ 。
(4)实验③中根据图象得V(Oa):V(ab):V(bc)=___________ 。
(5)B的最高价氧化物对应的水化物的极稀的溶液,与D的单质反应时,还原产物可用作化肥,该物质溶于水时会吸热。写出该反应的离子方程式___________ 。
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中,向其中加入稀盐酸,无现象。再加入BaCl2溶液,出现白色沉淀。
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如图所示。

(1)D的元素符号是
(2)B、C、E的简单气态氢化物的沸点高低顺序为
(3)经测定甲晶体的摩尔质量为453 g/mol,其中阳离子和阴离子物质的量之比为
 ,则甲晶体的化学式为
,则甲晶体的化学式为(4)实验③中根据图象得V(Oa):V(ab):V(bc)=
(5)B的最高价氧化物对应的水化物的极稀的溶液,与D的单质反应时,还原产物可用作化肥,该物质溶于水时会吸热。写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A_______ ,B________ ,C________ ,D________ ,E__________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:____________ 。
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:______________ 。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)_______________ 。
(1)写出下列元素符号:A
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
您最近一年使用:0次
2019-06-23更新
|
106次组卷
|
2卷引用:黑龙江省牡丹江市第三高级中学2018-2019学年高一下学期期中考试化学试题
解题方法
7 . 在下述转化关系中,已知B、D都是淡黄色固体,且A与D为单质,并可反应生成离子化合物。试回答:
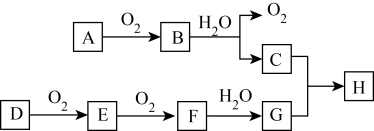
(1) G的化学式为________ ;
(2)写出B的电子式______________ 。
(3)写出B +水→C的化学反应方程式_______ 。
(4)B和E反应也可生成H,则该反应的化学方程式为____ 。

(1) G的化学式为
(2)写出B的电子式
(3)写出B +水→C的化学反应方程式
(4)B和E反应也可生成H,则该反应的化学方程式为
您最近一年使用:0次
11-12高二下·四川成都·阶段练习
解题方法
8 . A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1)X在周期表中的位置是_______
(2)化合物Y2X2的电子式为_______ ;它含有的化学键类型有 _______
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_______ 。
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_______ 。
(5)写出化合物Y2X2与水反应的离子方程式_______ 。
(6)B的最高价氧化物的结构式为_______ 。
(1)X在周期表中的位置是
(2)化合物Y2X2的电子式为
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为
(5)写出化合物Y2X2与水反应的离子方程式
(6)B的最高价氧化物的结构式为
您最近一年使用:0次
解题方法
9 . 短周期主族元素X、Y、Z的原子序数依次增大,在周期表中Y分别与X、Z相邻。回答下列问题:
(1)若X、Y和Z的单质都为金属,Y与Z左右相邻,Z的单质被称为“国防金属”。则Y的单质在O2中燃烧产物中含有的化学键为____________________________ 。
(2)若X、Y和Z位于同一周期,高纯度Y单质常用于制造太阳能电池。则除去Y的氧化物中所含X氧化物杂质的方法是________________ 过滤、洗涤、干燥。
(3)若X原子最外层电子数是电子层数的2倍,Z与Y同主族,则X、Y、Z的简单气态氢化物中,沸点最高的是________________ 。(填化学式)
(4)若Y的原子序数等于X的2倍,T是Z的气态氢化物。
①写出Z2X对应的水化物分子的电子式________________ 。
②M是短周期中原子半径最大的元素,由M、X、Y元素组成的一种化合物与T的水溶液反应产生刺激性气味的气体,溶液变浑浊。写出反应的离子方程式:____________ 。
(1)若X、Y和Z的单质都为金属,Y与Z左右相邻,Z的单质被称为“国防金属”。则Y的单质在O2中燃烧产物中含有的化学键为
(2)若X、Y和Z位于同一周期,高纯度Y单质常用于制造太阳能电池。则除去Y的氧化物中所含X氧化物杂质的方法是
(3)若X原子最外层电子数是电子层数的2倍,Z与Y同主族,则X、Y、Z的简单气态氢化物中,沸点最高的是
(4)若Y的原子序数等于X的2倍,T是Z的气态氢化物。
①写出Z2X对应的水化物分子的电子式
②M是短周期中原子半径最大的元素,由M、X、Y元素组成的一种化合物与T的水溶液反应产生刺激性气味的气体,溶液变浑浊。写出反应的离子方程式:
您最近一年使用:0次
解题方法
10 . Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体。Q和X形成的离子化合物XQ是碱石灰的主要成分。X、Y、Z位于同一周期,Y的外围电子数是最外层电子数的6倍,Z位于ds区且不能和稀硫酸反应生成H2。请回答下列问题:
(1)Q的价层电子排布式为___________________ ,L的含氧酸HLO3中L的杂化方式为__________ ,酸根LO3-的离子构型为________________ 。
(2)ZR42-的配体是______ ,在ZSO4溶液中加入过量KCN,生成配合物[Z(CN)4]2—,则1mol该配合物中含有的π键的数目是_______ 。与Z同周期的元素中,与Z原子最外层电子数相等的元素还有_________ (填元素符号)
(3)Y的氧化物呈如下图所示的无限链状结构,则该氧化物的化学式为______________ 。
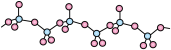
(4)X和Z的晶体堆积模型相同,配位数为______________ ,已知X原子半径约为200pm,则晶体X的密度为__________________ g/cm3(计算结果保留两位有效数字)。
(5)XL2晶体含有层状结构,其层内有强极性共价键,层间以范德华力相连接,则XL2的晶体类型是___________ 。
(1)Q的价层电子排布式为
(2)ZR42-的配体是
(3)Y的氧化物呈如下图所示的无限链状结构,则该氧化物的化学式为

(4)X和Z的晶体堆积模型相同,配位数为
(5)XL2晶体含有层状结构,其层内有强极性共价键,层间以范德华力相连接,则XL2的晶体类型是
您最近一年使用:0次



