名校
解题方法
1 . 回答下列问题
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。
① NH3分子的空间结构是_______ ;N2H4分子中氮原子轨道的杂化类型是 _______ 。
② 肼可用作火箭燃料,燃烧时发生的反应是N2O4(l) + 2N2H4(l)=3N2(g) + 4H2O(g) ΔH= -1038.7 kJ·mol-1,若该反应中有4 mol N-H断裂,则形成的 π 键有_______ mol。
③ 肼能与硫酸反应生成N2H6SO4,N2H6SO4与硫酸铵化合物类型相同,则N2H6SO4晶体不存在_______ (填标号)。
a. 离子键 b. 共价键 c. 范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
① H2Se的还原性比H2S_______ (填“强”或“弱”)。气态SeO3分子的空间结构为_______ ,SO2的VSEPR模型为_______ ,空间结构为_______ 。
② H2O内的O-H、水分子间的范德华力和氢键,从强到弱依次为_______ ,H+可与H2O形成H3O+,H3O+中O采用_______ 杂化,H3O+中H-O-H键角比H2O中的_______ (填“大”或“小”)
(1)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。
① NH3分子的空间结构是
② 肼可用作火箭燃料,燃烧时发生的反应是N2O4(l) + 2N2H4(l)=3N2(g) + 4H2O(g) ΔH= -1038.7 kJ·mol-1,若该反应中有4 mol N-H断裂,则形成的 π 键有
③ 肼能与硫酸反应生成N2H6SO4,N2H6SO4与硫酸铵化合物类型相同,则N2H6SO4晶体不存在
a. 离子键 b. 共价键 c. 范德华力
(2)第ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
① H2Se的还原性比H2S
② H2O内的O-H、水分子间的范德华力和氢键,从强到弱依次为
您最近一年使用:0次
2022-07-30更新
|
338次组卷
|
2卷引用:天津市第三中学2021-2022学年高二下学期期末质量检测化学试题
解题方法
2 . 元素周期表第IIIA族包括B、Al、Ga等元素,它们参与形成的化合物有重要研究和应用价值,回答下列问题:
(1)Ga原子的价电子排布式为___________ ;Ga、As和Se的第一电离能由小到大的顺序是___________ 。
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。
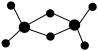
①该分子中Al原子采取___________ 杂化。
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有___________ (填标号)。
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为___________ 。
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是___________ 。
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的___________ (填“正四面体形” 或“正八面体形”)空隙。已知GaN的密度为ρ g/cm3,Ga和As的摩尔质量分别为a g/mol和b g/mol,则GaN晶胞的边长为___________ pm(列出表达式)。

(1)Ga原子的价电子排布式为
(2)实验发现,氯化铝的蒸气或溶于非极性溶剂中或处于熔融状态时,都以二聚态(Al2Cl6)形式存在。其球棍模型如图所示。

①该分子中Al原子采取
②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[Al(OH)4]-中存在的化学作用力类型有
A.离子键 B.极性共价键 C.金属键 D.非极性共价键 E.配位键 F.σ键 G.氢键
(3)更高温度下Al2Cl6二聚体则离解成AlCl3,BF3是AlCl3的一种等电子体,结合价层电子对互斥理论判断,BF3的分子构型为
(4)GaN是第三代半导体材料的研究热点,在干燥的NH3气流中焙烧磨细的GaAs可制得GaN。GaN熔点约为1500℃,GaAs熔点为1238℃,GaN熔点高于GaAs的原因是
(5)GaN的其中一种晶胞结构如图所示,与金刚石的晶体结构高度相似。该晶胞中Ga原子处于N原子形成的

您最近一年使用:0次
3 . 下表列出了①~⑦共7种元素在元素周期表中的位置。
回答下列问题:
(1)①可以形成原子空间排列方式不同的多种单质,这些不同的单质之间互称为_______ 。
(2)②形成的单质的电子式为_______ 。
(3)⑤的单质在工业上常用于冶炼熔点较高的金属,如用 冶炼
冶炼 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(4)③⑤⑦三种元素的简单离子半径由大到小的顺序是_______ (填离子符号)。
(5)④的单质在③的单质中燃烧形成的化学键有_______ 、_______ 。
(6)根据元素周期律,②的非金属性比⑥强,但②的单质却比⑥的单质稳定,原因是_______ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
(1)①可以形成原子空间排列方式不同的多种单质,这些不同的单质之间互称为
(2)②形成的单质的电子式为
(3)⑤的单质在工业上常用于冶炼熔点较高的金属,如用
 冶炼
冶炼 ,该反应的化学方程式为
,该反应的化学方程式为(4)③⑤⑦三种元素的简单离子半径由大到小的顺序是
(5)④的单质在③的单质中燃烧形成的化学键有
(6)根据元素周期律,②的非金属性比⑥强,但②的单质却比⑥的单质稳定,原因是
您最近一年使用:0次
解题方法
4 . 已知 A、B、C、D、E 是五种短周期的主族元素,它们的原子序数依次增大, A 是所有元素中原子半径最小的元素,B、C 组成的某一种化合物能引起温室效应;常温下, 金属 D 单质投入水中能与水剧烈反应;E 的单质在常温下是一种有色的气体。请按要求回答下列几个问题:
(1)B、D 的元素名称分别为:_____ 、_____ ;
(2)E 的最高价氧化物对应的水化物的化学式为:_____ ;
(3)C 离子的结构示意图为:_____ ;
(4)B、C、D 三种元素的原子半径从大到小的顺序为_____ (用元素符号表示);
(5)B、E 的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____ (用对应的化学式表示)
(6) 写出 C、D 两种元素组成的阴、阳离子个数比为 1:2 且既含离子键又含有非极性共价键的化合物的电子式:_____ 。
(1)B、D 的元素名称分别为:
(2)E 的最高价氧化物对应的水化物的化学式为:
(3)C 离子的结构示意图为:
(4)B、C、D 三种元素的原子半径从大到小的顺序为
(5)B、E 的最高价氧化物对应水化物的酸性从强到弱的顺序为:
(6) 写出 C、D 两种元素组成的阴、阳离子个数比为 1:2 且既含离子键又含有非极性共价键的化合物的电子式:
您最近一年使用:0次
名校
解题方法
5 . 物质的类别和核心元素的化合价是研究物质性质的两个重要角度。部分含氮及氯物质的价类二维图如下,回答下列问题:
(2)固氮是将游离态的氮转变为氮的化合物,一种新型人工固氮的原理如图:_______ 为氧化还原反应(填编号)。
b.参与该人工固氮转化的物质中含有的化学键类型有_______ (填字母)。
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成_______ mol O2。
(3)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:_______ 。
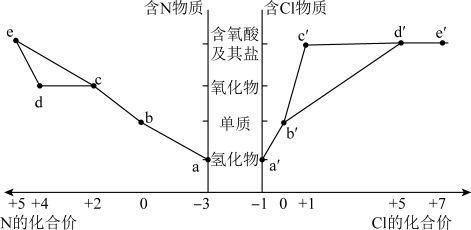
| A.a和c可在一定条件下反应生成b |
| B.工业上通过a→b→d→e来制备HNO3 |
C.浓的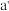 溶液和浓的 溶液和浓的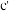 溶液反应可以得到 溶液反应可以得到 |
D.a和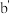 可在一定条件下反应生成b 可在一定条件下反应生成b |
b.参与该人工固氮转化的物质中含有的化学键类型有
A.离子键 B.极性键 C.非极性键 D.氢键
c.假设每一步均完全转化,每生成1 mol NH3,同时生成
(3)由氮和氯组成的一种二元化合物分子中,各原子最外层均达到8电子的稳定结构,该液态化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:
您最近一年使用:0次
2023-04-07更新
|
255次组卷
|
2卷引用:四川省成都市树德中学2022-2023学年高一下学期4月月考化学试题
名校
6 . 食品添加剂可以改善食品的色香、味等品质,能更好地满足吃货们的心愿,丰富舌尖上的营养和美味。请回答下列问题:
I.磷酸氢钙CaHPO4是一种常用的营养强化剂和膨松剂,可以用于糕点、代乳品、婴幼儿配方食品等。
(1)Ca的结构示意图为_______ 。中子数为23的P,其核素符号为_______ 。
(2)下列说法中不正确的是_______。
II.短周期主族元素A、B、C、D、E、F都可能存在于某些食品添加剂中,且它们的原子序数依次增大,A的一种核素原子核内没有中子,B是地壳中含量最多的元素,C元素的原子在同周期主族元素中原子半径最大,D元素原子的最外层电子数与电子层数相等,B、E元素的原子最外层电子数相同。请回答下列问题:
(3)E元素在元素周期表中的位置为_______ 。
(4)由A、B、F三种元素组成的简单化合物的电子式为_______ 。
(5)B单质与C单质在加热条件下反应,所得产物中存在的化学键类型为_______ 。
(6)B、C、D对应简单离子的半径由小到大的顺序为_______ (用具体微粒符号表示)。
(7)D元素最高价氧化物与C元素最高价氧化物对应水化物的溶液反应的离子方程式为_______ 。
I.磷酸氢钙CaHPO4是一种常用的营养强化剂和膨松剂,可以用于糕点、代乳品、婴幼儿配方食品等。
(1)Ca的结构示意图为
(2)下列说法中不正确的是_______。
| A.热稳定性; H2O> NH3> PH3 | B.碱性: KOH >Ca(OH)2>Al(OH)3 |
| C.酸性: H3PO4>H2SiO3> H2CO3 | D.还原性: O2-<S2-<P3- |
II.短周期主族元素A、B、C、D、E、F都可能存在于某些食品添加剂中,且它们的原子序数依次增大,A的一种核素原子核内没有中子,B是地壳中含量最多的元素,C元素的原子在同周期主族元素中原子半径最大,D元素原子的最外层电子数与电子层数相等,B、E元素的原子最外层电子数相同。请回答下列问题:
(3)E元素在元素周期表中的位置为
(4)由A、B、F三种元素组成的简单化合物的电子式为
(5)B单质与C单质在加热条件下反应,所得产物中存在的化学键类型为
(6)B、C、D对应简单离子的半径由小到大的顺序为
(7)D元素最高价氧化物与C元素最高价氧化物对应水化物的溶液反应的离子方程式为
您最近一年使用:0次
7 . 短周期主族元素A、B、C、D、E的原子序数依次增大,B、E处于同一主族。A的一种同位素在考古研究中用于测定一些文物的年代,B原子的最外层电子数是内层电子总数的3倍,D在同周期元素形成的离子中半径最小,C与B能形成C2B、C2B2型化合物。
请回答下列问题:
(1)A在元素周期表中的位置为______ ,A与原子半径最小的原子形成的10电子分子的空间结构为______ 。
(2)A、E中非金属性较强的是______ (填元素符号),两者可形成AE2型化合物,该化合物的结构式为_______ 。
(3)C、D的最高价氧化物的水化物之间反应的离子方程式为________ 。
(4)C、E可形成化合物M,用电子式表示M的形成过程_______ 。
(5)C2B2中的化学键类型为______ (填“离子键”、“极性键”或“非极性键”)。
请回答下列问题:
(1)A在元素周期表中的位置为
(2)A、E中非金属性较强的是
(3)C、D的最高价氧化物的水化物之间反应的离子方程式为
(4)C、E可形成化合物M,用电子式表示M的形成过程
(5)C2B2中的化学键类型为
您最近一年使用:0次
名校
8 . 回答下列问题
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是_______ ;既含离子键又含极性键的是_______ 。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为_______ ;若XY2为共价化合物时(已知硫磺易溶于其中),其结构式为_______ 。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是_______ (填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是_______ 。
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
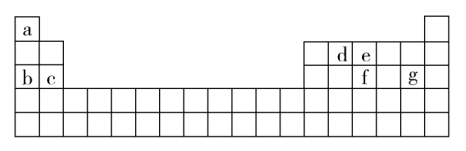
①元素的原子间反应最容易形成离子键的是_______ (填选项,下同),容易形成共价键的是_______ 。
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式_______ 。
(5)a与e能形成氢化物的空间构型为_______ ,其所含化学键类型为_______ ,将其通入到炽热的黑色氧化铜粉末中,出现了红色固体,其他产物对环境友好,请写出相关方程:_______ 。
(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既含离子键又含非极性键的是
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190 ℃,但在180 ℃就开始升华。据此判断,氯化铝是
(4)现有a~g 7种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式
(5)a与e能形成氢化物的空间构型为
您最近一年使用:0次
2022-10-24更新
|
268次组卷
|
2卷引用:陕西省延安市第一中学2021-2022学年高一下学期期中考试化学试题
名校
解题方法
9 . 下表为元素周期表的一部分,请回答有关问题:
(1)已知元素⑩的一种核素,其中子数为45,用原子符号表示该核素为_________
(2)由元素②和④形成的三核直线形分子的结构式为_________
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程_______________
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为______ (填“离子键”、“极性键”或“非极性键”)④和⑦的氢化物稳定性较强的是__________ 、沸点较高的是_________ (填化学式)⑧和⑩的氢化物还原性较强的是_______ (填化学式)
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是_________ (用离子符号表示);元素⑨的最高价氧化物的水化物与元素⑥的最高价氧化物对应的水化物反应的离子方程式为__________
(6)能比较元素⑦和⑧非金属性强弱的实验事实是_________ (填字母序号)。
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)由元素②和④形成的三核直线形分子的结构式为
(3)用电子式表示元素⑤和⑦的原子形成的化合物(该化合物含有三个原子核)的形成过程
(4)由上述元素④和⑤构成的淡黄色固体,该化合物所含的化学键类型为
(5)元素⑦、⑧、⑨的离子半径由大到小的顺序是
(6)能比较元素⑦和⑧非金属性强弱的实验事实是
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
您最近一年使用:0次
解题方法
10 . 镓及其化合物在半导体领域有重要应用。回答下列问题:
(1)已知镓有两种同位素 和
和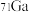 ,镓的平均相对原子质量为69.72,则
,镓的平均相对原子质量为69.72,则 和
和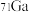 在自然界里的丰度之比为
在自然界里的丰度之比为_______ 。
(2)通常情况下, 的熔点为
的熔点为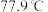 ,沸点为
,沸点为 ,其二聚物结构式为
,其二聚物结构式为_______ 。
(3)酞菁和氯代酞菁镓结构如图所示:

①酞菁分子中C的杂化方式为_______ 。
②镓位于元素周期表的_______ 区。
③氯代酞菁镓中含有的化学键有_______ (填序号)
A.氢键 B.配位键 C.非极性键 D.极性键
(4)某氧化镓晶体晶胞结构如图所示,其中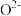 位于顶点、上下面心和内部,
位于顶点、上下面心和内部,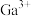 位置未标出。
位置未标出。

①该晶胞中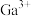 的个数为
的个数为_______ 。
②已知氧离子半径为anm,晶胞的高为bnm,该晶体的密度为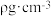 ,则阿伏加德罗常数
,则阿伏加德罗常数
_______ (用含a、b、 的代数式表示)。
的代数式表示)。
(1)已知镓有两种同位素
 和
和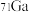 ,镓的平均相对原子质量为69.72,则
,镓的平均相对原子质量为69.72,则 和
和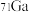 在自然界里的丰度之比为
在自然界里的丰度之比为(2)通常情况下,
 的熔点为
的熔点为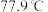 ,沸点为
,沸点为 ,其二聚物结构式为
,其二聚物结构式为(3)酞菁和氯代酞菁镓结构如图所示:

①酞菁分子中C的杂化方式为
②镓位于元素周期表的
③氯代酞菁镓中含有的化学键有
A.氢键 B.配位键 C.非极性键 D.极性键
(4)某氧化镓晶体晶胞结构如图所示,其中
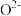 位于顶点、上下面心和内部,
位于顶点、上下面心和内部,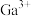 位置未标出。
位置未标出。
①该晶胞中
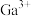 的个数为
的个数为②已知氧离子半径为anm,晶胞的高为bnm,该晶体的密度为
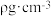 ,则阿伏加德罗常数
,则阿伏加德罗常数
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



