1 . 1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一、元素周期表与元素周期律在化学学习研究中有很重要的作用。下表是元素周期表的一部分,列出了①~⑩10种元素在周期表中的位置。
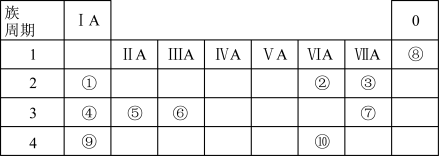
回答下列问题:
(1)①~⑩元素性质最不活泼的元素是___________ (填元素符号)。
(2)①④⑤⑥中最高价氧化物的水化物碱性最强的是___________ (填化学式),该水化物所含的化学键类型有___________ 。
(3)元素③⑥⑦的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)元素②的简单氢化物的电子式为___________ ,该氢化物常温下和元素④的单质反应的离子方程式是___________ 。
(5)元素⑩[硒(Se)]被誉为“生命元素”,科学补硒可以减少疾病的发生。铜仁市“富硒”耕地丰富,产出的“富硒”农产品受市场青睐,为“黔货出山”和“乡村振兴”作出了重要贡献。下列推断正确的是___________(填字母)。

回答下列问题:
(1)①~⑩元素性质最不活泼的元素是
(2)①④⑤⑥中最高价氧化物的水化物碱性最强的是
(3)元素③⑥⑦的简单离子半径由大到小的顺序是
(4)元素②的简单氢化物的电子式为
(5)元素⑩[硒(Se)]被誉为“生命元素”,科学补硒可以减少疾病的发生。铜仁市“富硒”耕地丰富,产出的“富硒”农产品受市场青睐,为“黔货出山”和“乡村振兴”作出了重要贡献。下列推断正确的是___________(填字母)。
A. 既有氧化性又有还原性 既有氧化性又有还原性 |
B. 的稳定性比 的稳定性比 强 强 |
C. 的酸性强于 的酸性强于 |
D. 在一定条件下可与NaOH溶液反应 在一定条件下可与NaOH溶液反应 |
您最近一年使用:0次
名校
2 . 卤族元素在性质上具有相似性与递变性。为了验证卤族部分元素递变规律,设计如图装置进行实验。请回答下列问题。
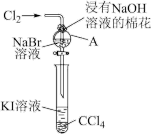
(1)A中发生反应的化学方程式是_______ 。
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是_______ 。
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应_______  填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为_______ 。
(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱_______ 。
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为_______ 。
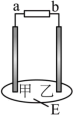
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是
(8)下图是用强光照射广口瓶中新制氯水时传感器所获得数据的图像,下列各项代表纵坐标的物理量,其中与图像不相符的是

(9)下列变化不需要破坏化学键的是

(1)A中发生反应的化学方程式是
(2)根据上述实验操作步骤,为确保“非金属性:氯>溴>碘”的实验结论可靠,你认为做好本实验最关键因素是
(3)下列性质的递变规律正确,且能作为卤族元素非金属性递变规律判断依据的是
| A.Cl-、Br-、I-的还原性逐渐增强 | B.Cl2、Br2、I2的熔点逐渐升高 |
| C.HCl、HBr、HI的酸性逐渐减弱 | D.HCl、HBr、HI的稳定性逐渐减弱 |
IBr、 ICl等称为卤素互化物,(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质与卤素单质相似,请回答下列问题。
(4)氯化碘 ( ICl)能与水发生反应:ICl+H2O= HIO+ HCl,该反应
 填“是”或“不是”
填“是”或“不是” 氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为
氧化还原反应; (CN)2与NaOH水溶液反应的化学方程式为(5)从原子结构角度解释分子(CN)2中两种元素非金属性的强弱
(6)已知某些离子的还原性强弱顺序为I->SCN->CN->Br->Cl-。在NaBr和KSCN的混合溶液中通入(CN)2,反应的离子方程式为
(7)如图所示,E是用饱和NaCl溶液和淀粉-KI溶液的混合液湿润的滤纸,用石墨做电极,通电后发现乙周围滤纸褪为蓝色,则下列判断正确的是

| A.b是阳极,a是阴极 | B.a是正极,b是负极 |
| C.乙是正极,甲是负极 | D.乙是阳极,甲是阴极 |

| A.溶液中氯离子的浓度 | B.溶液的 pH |
| C.瓶中氧气的体积分数 | D.溶液的导电能力 |
| A.液态水变为水蒸气 | B.HCl 气体溶于水 |
| C.NaHCO3 受热分解 | D.NaCl 熔化 |
您最近一年使用:0次
3 . 如图所示为元素周期表的一部分,表中每个字母分别代表一种元素。
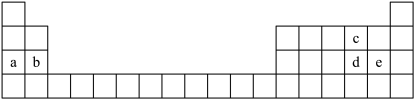
回答下列问题:
(1)d的阴离子的结构示意图为_______ 。
(2)a和c形成的原子个数比为1:1的化合物中所含化学键类型为_______ 。
(3)d和e的最高价氧化物对应水化物的酸性由强到弱的顺序_______ (用化学式表示)。
(4)为验证卤素单质氧化性的相对强弱,某同学设计了如下实验(夹持装置略)
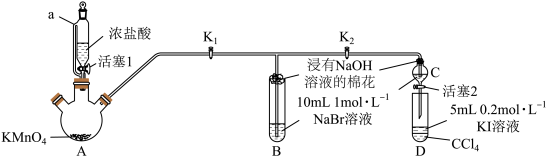
实验过程:
I.打开 、
、 ,打开活塞1,当B和C中的溶液都变为黄色时,关闭
,打开活塞1,当B和C中的溶液都变为黄色时,关闭 。
。
II.继续通气体,当B中溶液变为棕红色时,关闭活塞1。
III. ……
①装置a的名称为_______ 。
②过程I,B、C中的溶液都变黄色的原因_______ (用离子方程式表示)。
③过程II的目的是_______ 。
④过程III的目的是验证溴的氧化性强于碘。简述操作过程_______ 。

回答下列问题:
(1)d的阴离子的结构示意图为
(2)a和c形成的原子个数比为1:1的化合物中所含化学键类型为
(3)d和e的最高价氧化物对应水化物的酸性由强到弱的顺序
(4)为验证卤素单质氧化性的相对强弱,某同学设计了如下实验(夹持装置略)

实验过程:
I.打开
 、
、 ,打开活塞1,当B和C中的溶液都变为黄色时,关闭
,打开活塞1,当B和C中的溶液都变为黄色时,关闭 。
。II.继续通气体,当B中溶液变为棕红色时,关闭活塞1。
III. ……
①装置a的名称为
②过程I,B、C中的溶液都变黄色的原因
③过程II的目的是
④过程III的目的是验证溴的氧化性强于碘。简述操作过程
您最近一年使用:0次
2023高三·全国·专题练习
4 . 科学家最近研制出有望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N−N−N键角都是108.1°,下列有关N(NO2)3的说法正确的是
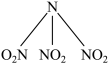

| A.分子中N、O原子间形成的共价键是非极性键 | B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 | D.分子中四个氮原子围成一个空间正四面体 |
您最近一年使用:0次
5 . 过氧化氢( )溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。
)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。 与
与 反应生成
反应生成 ,
, 的分子结构如图所示。下列说法正确的是
的分子结构如图所示。下列说法正确的是
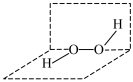
 )溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。
)溶液俗称双氧水,医疗上常用3%的双氧水进行伤口消毒。 与
与 反应生成
反应生成 ,
, 的分子结构如图所示。下列说法正确的是
的分子结构如图所示。下列说法正确的是
A.过氧化氢的电子式为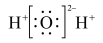 |
B. 为含有极性键和非极性键的共价化合物 为含有极性键和非极性键的共价化合物 |
C. 既有氧化性又有还原性 既有氧化性又有还原性 |
D. 与 与 反应过程中有共价键断裂,同时有共价键和离子键形成 反应过程中有共价键断裂,同时有共价键和离子键形成 |
您最近一年使用:0次
2023-07-12更新
|
140次组卷
|
2卷引用:云南省玉溪市2022-2023学年高一下学期期末考试化学试题
解题方法
6 . 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如图。下列说法错误的是
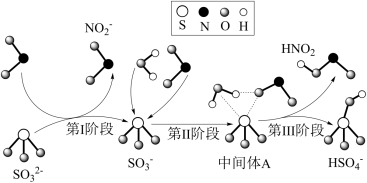

A.氧化性:NO2>SO ,还原性:SO ,还原性:SO >HNO2 >HNO2 |
B.第II、III阶段总的化学方程式为:SO +H2O+NO2=HNO2+HSO +H2O+NO2=HNO2+HSO |
| C.NO2在所有过程中都是被还原 |
| D.上述反应过程中,S的成键数目保持不变 |
您最近一年使用:0次
2022-11-20更新
|
1296次组卷
|
3卷引用:山东日照市莒县一中2022-2023学年高一下学期3月月考化学试题
山东日照市莒县一中2022-2023学年高一下学期3月月考化学试题山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题(已下线)专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)
名校
7 . 食品添加剂可以改善食品的色香、味等品质,能更好地满足吃货们的心愿,丰富舌尖上的营养和美味。请回答下列问题:
I.磷酸氢钙CaHPO4是一种常用的营养强化剂和膨松剂,可以用于糕点、代乳品、婴幼儿配方食品等。
(1)Ca的结构示意图为_______ 。中子数为23的P,其核素符号为_______ 。
(2)下列说法中不正确的是_______。
II.短周期主族元素A、B、C、D、E、F都可能存在于某些食品添加剂中,且它们的原子序数依次增大,A的一种核素原子核内没有中子,B是地壳中含量最多的元素,C元素的原子在同周期主族元素中原子半径最大,D元素原子的最外层电子数与电子层数相等,B、E元素的原子最外层电子数相同。请回答下列问题:
(3)E元素在元素周期表中的位置为_______ 。
(4)由A、B、F三种元素组成的简单化合物的电子式为_______ 。
(5)B单质与C单质在加热条件下反应,所得产物中存在的化学键类型为_______ 。
(6)B、C、D对应简单离子的半径由小到大的顺序为_______ (用具体微粒符号表示)。
(7)D元素最高价氧化物与C元素最高价氧化物对应水化物的溶液反应的离子方程式为_______ 。
I.磷酸氢钙CaHPO4是一种常用的营养强化剂和膨松剂,可以用于糕点、代乳品、婴幼儿配方食品等。
(1)Ca的结构示意图为
(2)下列说法中不正确的是_______。
| A.热稳定性; H2O> NH3> PH3 | B.碱性: KOH >Ca(OH)2>Al(OH)3 |
| C.酸性: H3PO4>H2SiO3> H2CO3 | D.还原性: O2-<S2-<P3- |
II.短周期主族元素A、B、C、D、E、F都可能存在于某些食品添加剂中,且它们的原子序数依次增大,A的一种核素原子核内没有中子,B是地壳中含量最多的元素,C元素的原子在同周期主族元素中原子半径最大,D元素原子的最外层电子数与电子层数相等,B、E元素的原子最外层电子数相同。请回答下列问题:
(3)E元素在元素周期表中的位置为
(4)由A、B、F三种元素组成的简单化合物的电子式为
(5)B单质与C单质在加热条件下反应,所得产物中存在的化学键类型为
(6)B、C、D对应简单离子的半径由小到大的顺序为
(7)D元素最高价氧化物与C元素最高价氧化物对应水化物的溶液反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 从宏观和微观两个角度认识元素的单质及其化合物是学好中学化学的重要基础。
(1)组成 的三种元素,其对应的简单离子半径由小到大的顺序为
的三种元素,其对应的简单离子半径由小到大的顺序为___________ 。
(2) 、
、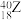 、
、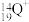 、
、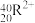 、
、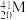 5种微粒,所属元素的种类有
5种微粒,所属元素的种类有___________ 种
(3)下列各组物质中,含有化学键类型都相同的是___________。
(4)将HCl和NaCl分别溶于水。下列说法正确的是___________。
(5)能用于比较Cl与S非金属性强弱的依据是___________。
(1)组成
 的三种元素,其对应的简单离子半径由小到大的顺序为
的三种元素,其对应的简单离子半径由小到大的顺序为(2)
 、
、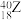 、
、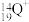 、
、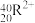 、
、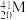 5种微粒,所属元素的种类有
5种微粒,所属元素的种类有(3)下列各组物质中,含有化学键类型都相同的是___________。
| A.HI和NaCl | B.NaF和KOH | C.CO和HCl | D. 和NaBr 和NaBr |
| A.HCl的离子键被破坏 | B.NaCl的共价键被破坏 |
| C.HCl和NaCl的化学键均遭破坏 | D.HCl和NaCl的化学键均未遭破坏 |
| A.熔沸点:硫单质>氯单质 | B.酸性: |
C.热稳定性: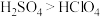 | D.氧化性: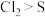 |
您最近一年使用:0次
名校
9 . 表中相关物质的信息都正确的一项是
| 选项 | 化学式 | 电子式或含有的化学键类型 | 物质的性质 | 与性质相对应的用途 |
| A |  | 离子键、共价键 | 强氧化性 | 消毒液 |
| B |  | 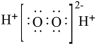 | 不稳定,易分解 | 医用消毒剂 |
| C | W(钨) | 金属键 | 银白色,具有金属光泽 | 制成灯丝 |
| D |  | 离子键 | 受热易分解 | 治疗胃酸过多 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数之和相同的甲、乙、丙三种分子,丙的水溶液可刻蚀玻璃,丁和戊是由X、Y、Z中的两种元素组成的二元化合物,反应①②均是在催化剂下发生的反应。上述物质有如图所示转化关系,下列说法正确的是
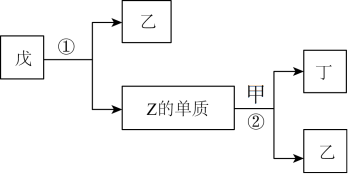

| A.四种元素形成的单质中W的单质的氧化性最弱 |
| B.Y、Z、W的简单氢化物的沸点属W的最高 |
| C.X、Y、Z中任两种元素都能形成多种化合物 |
| D.甲、乙、丙、丁、戊中均只含极性共价键 |
您最近一年使用:0次



