名校
解题方法
1 . 某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为 配体;四面体中心为硼原子,顶点均为氢原子,其摩尔质量为
配体;四面体中心为硼原子,顶点均为氢原子,其摩尔质量为 ,下列说法正确的是
,下列说法正确的是
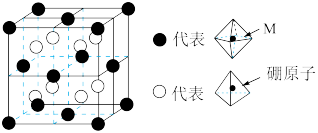
 配体;四面体中心为硼原子,顶点均为氢原子,其摩尔质量为
配体;四面体中心为硼原子,顶点均为氢原子,其摩尔质量为 ,下列说法正确的是
,下列说法正确的是
| A.金属离子M与硼原子的配位数之比2∶1 |
B.金属离子的价电子排布式为 |
C.化学式为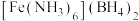 |
| D.该化合物中存在金属键、离子键、极性键和配位键 |
您最近一年使用:0次
2023-01-15更新
|
657次组卷
|
3卷引用:黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题
黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题山东省济宁市2022-2023学年高三上学期期末考试化学试题(已下线)专题卷20 《物质结构与性质》选择题分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
名校
2 . 我国淘金者常用氰化法选金,在氰化法选金过程中,一旦氰化物处理不当,会对水土造成污染。在实际生产中,常用反应:2KCN+8KOH+5Cl2=2CO2 +N2+10KCl+4H2O来处理氰化物。下列说法不正确的是
| A.该反应的还原剂是KCN |
| B.该反应有极性键、非极性键的断裂和形成 |
C.CO2的电子式为 |
| D.该反应若生成的CO2和N2一共1.5mol,则转移的电子为5mol |
您最近一年使用:0次
2021-12-19更新
|
1580次组卷
|
3卷引用:黑龙江省齐齐哈尔三立高中2022-2023学年高一下学期期初考试化学试题
名校
3 . 原子序数依次增大的五种短周期主族元素X、Y、Z、Q、W组成的化合物的结构如图所示,基态Q原子最外层电子是电子层数的3倍。下列说法正确的是


| A.W能与硫酸铜溶液反应,制备出铜单质 |
| B.W的氢化物是共价化合物 |
| C.W和Z形成的化合物受到撞击时能瞬间释放出大量的气体 |
| D.由X、Y、Q、W形成化合物一定显碱性 |
您最近一年使用:0次
2021-06-04更新
|
1457次组卷
|
4卷引用:黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题
名校
4 . 下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
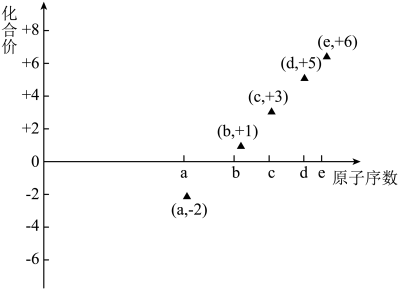

| A.31d和33d属于同种核素 |
| B.气态氢化物的稳定性:a>d>e |
| C.b、c的最高价氧化物对应水化物可以反应 |
| D.a和b形成的化合物不可能含共价键 |
您最近一年使用:0次
2019-06-26更新
|
1646次组卷
|
5卷引用:黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题
名校
解题方法
5 . Ⅰ:下列结论错误的是_________ (填序号)
①单质的熔点:Li>Na>K ②氢化物的稳定性:HF>H2S>PH3>SiH4
③还原性:H2S>HCl>HBr>HI ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥密度:F2>Cl2>Br2 ⑦沸点:NH3>PH3
Ⅱ:(1)下列几种物质: ①MgCl2 ②HCl ③Na ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦NH3 ⑧I2 ⑨Ne。含有非极性共价键的离子化合物是___________ ;不存在化学键的是__________ 。(填序号)
(2)CO2的电子式为__________ ;NH3的结构式为__________ ;
(3)分析在下列变化中,微粒间作用力的变化(填选项):
①碘的升华破坏______________ ②HCl溶于水破坏_________________ 。
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力
Ⅲ:(1)下列变化完全符合下图图示的是:_______________ 。(填选项)
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水 ⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2·8H2O与NH4Cl反应
A.①②⑥ B.②⑤⑦ C.①②⑤⑥⑦ D.②⑤⑥⑦

(2)化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:P-P a kJ、 P-O b kJ、 O=O c kJ。已知:白磷(P4)和P4O6的分子结构如图所示(分子中所有原子均达到8电子稳定结构)。则1mol白磷(P4)燃烧生成P4O6放出_________ kJ热量。

①单质的熔点:Li>Na>K ②氢化物的稳定性:HF>H2S>PH3>SiH4
③还原性:H2S>HCl>HBr>HI ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥密度:F2>Cl2>Br2 ⑦沸点:NH3>PH3
Ⅱ:(1)下列几种物质: ①MgCl2 ②HCl ③Na ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦NH3 ⑧I2 ⑨Ne。含有非极性共价键的离子化合物是
(2)CO2的电子式为
(3)分析在下列变化中,微粒间作用力的变化(填选项):
①碘的升华破坏
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力
Ⅲ:(1)下列变化完全符合下图图示的是:
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④生石灰溶于水 ⑤二氧化碳与灼热的碳反应 ⑥碘的升华 ⑦Ba(OH)2·8H2O与NH4Cl反应
A.①②⑥ B.②⑤⑦ C.①②⑤⑥⑦ D.②⑤⑥⑦

(2)化学反应可视为旧键断裂和新键形成的过程。已知断开1mol下列化学键时需要吸收的能量分别为:P-P a kJ、 P-O b kJ、 O=O c kJ。已知:白磷(P4)和P4O6的分子结构如图所示(分子中所有原子均达到8电子稳定结构)。则1mol白磷(P4)燃烧生成P4O6放出

您最近一年使用:0次
名校
6 . 下列说法中正确的是( )
| A.CH4和BCl3分子中所有原子的最外层都达到了8电子稳定结构 |
| B.Na2O2、NaClO中所含化学键类型不完全相同 |
| C.Si与C同属ⅣA族,因此SiO2和CO2两种物质中微粒间作用完全相同 |
| D.氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成 |
您最近一年使用:0次
2018-06-16更新
|
2403次组卷
|
11卷引用:【全国百强校】黑龙江省大庆第一中学2017-2018学年高一下学期第三次阶段检测化学试题
【全国百强校】黑龙江省大庆第一中学2017-2018学年高一下学期第三次阶段检测化学试题黑龙江省哈尔滨师范大学青冈实验中学校2019届高三12月月考化学试题【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题1云南省文山州马关县二中2019-2020学年高二上学期9月份考试化学试题湖南省常德市淮阳中学2019-2020学年高一上学期期中考试化学试题人教版高中化学必修2第一章《物质结构 元素周期律》测试卷2【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题湖北省武汉市第三中学2019-2020学年高一下学期期中考试化学试题(已下线)练习13 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)四川省资阳市雁江区中和中学2020-2021学年高一下学期期中考试化学试题(已下线)专题1.1.1 反应热与焓变(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)
7 . 下表是元素周期表的一部分:
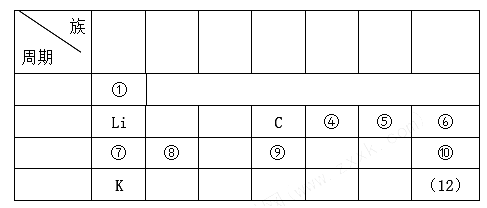
(1)表中元素______ 的非金属性最强(填写元素符号,下同);元素______ 的单质室温下呈液态,它的原子序数是_________ 。
(2)表中元素⑤和⑦、①和⑤均可以组成原子比例为1:1的物质,这两种物质内所含有相同的化学键是__________ (填写“离子键”、“极性共价键”或“非极性共价键”)。
(3)表中元素⑥⑩(12)氢化物的稳定性由大到小的顺序为:_________ (填写化学式,下同)。
(4)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是_____ 。
(5)用电子式表示表中⑧⑩两元素形成化合物的过程__________________ 。

(1)表中元素
(2)表中元素⑤和⑦、①和⑤均可以组成原子比例为1:1的物质,这两种物质内所含有相同的化学键是
(3)表中元素⑥⑩(12)氢化物的稳定性由大到小的顺序为:
(4)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是
(5)用电子式表示表中⑧⑩两元素形成化合物的过程
您最近一年使用:0次
名校
8 . 下列说法正确的是
| A.NaF、H2SO4中所含化学键类型相同 |
| B.氯化铵受热固体消失和干冰升华只需克服分子间作用力 |
| C.I2、Br2、Cl2、F2熔沸点逐渐降低 |
| D.HCl气体溶于水和NaOH熔化破坏的化学键类型相同 |
您最近一年使用:0次
2017-05-16更新
|
460次组卷
|
2卷引用:黑龙江省大庆实验中学2016-2017学年高一6月月考化学试题
名校
9 . 镍在金属羰基化合物(金属元素和CO中性分子形成的一类配合物)、金属储氢材料(能可逆地多次吸收、储存和释放H2的合金)等领域用途广泛。
(1)基态Ni原子核外电子排布式为__________________________ 。
(2)Ni(CO)4中镍元素的化合价为__________ ,写出与CO互为等电子体的带一个单位正电荷的阳离子为:_______ 。Ni(CO)4的一氯代物有2种,其空间构型为_______________ o
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示,则该晶体的化学式为_____________

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式:_______________ 。

与Ni2+配位的N原子有__________ 个,该配合物中存在的化学键有_________ (填序号)。
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(5)Ni与Fe的构型相同(体心立方堆积),Ni的摩尔质量为M g/mol,阿伏伽德罗常数为NA,密度为a g/cm3Ni原子的半径为_________ pm(金属小球刚性相切)
(1)基态Ni原子核外电子排布式为
(2)Ni(CO)4中镍元素的化合价为
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示,则该晶体的化学式为

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式:

与Ni2+配位的N原子有
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(5)Ni与Fe的构型相同(体心立方堆积),Ni的摩尔质量为M g/mol,阿伏伽德罗常数为NA,密度为a g/cm3Ni原子的半径为
您最近一年使用:0次
名校
10 . Q、W、X、Y、Z是原子序数依次增大的短周期元素。X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z元素的原子最外层电子数相同,Z元素的原子的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是
| A.X、Y的最高价氧化物的水化物之间不能发生反应 |
| B.W、X两种元素形成的简单离子的半径大小顺序:X>W |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
您最近一年使用:0次
2017-04-13更新
|
862次组卷
|
4卷引用:黑龙江省哈尔滨第三中学2021届高三第二次模拟考试理科综合化学试题



