名校
解题方法
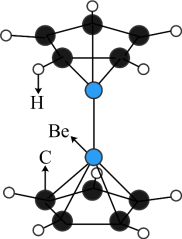
1 . 2023年6月,科学家首次合成含铍-铍能的固态化合物,相关成果发表于《科学》杂质。该分子入选2023年最“炫”分子榜单,其结构如图所示,回答下列问题: 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为_____ (填序号)。
A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
(3)“固态双铍化合物的化学式为_____ ,它不含_____ (填标号)。
A.极性键 B.非极性键 C.金属键 D. 键
键
(4)卤化铍的熔点如表所示:
① 中
中 原子的杂化方式为
原子的杂化方式为_____ ;
②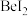
_____ (填“能”或“不能)溶于四氯化碳:
③ 、
、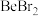 、
、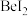 的熔点依次升高的原因是
的熔点依次升高的原因是_____ 。
(5) 易形成配离子
易形成配离子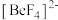 ,其中心阳离子的配位数为
,其中心阳离子的配位数为_____ ,配体是_____ (填化学符号),配离子的空间构型为_____ 。
(6)离子晶体中稳定配位多面体的理论半径比如表所示:
已知铍离子、氧离子的半径分别为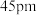 、
、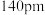 ,
, 的配位多面体是
的配位多面体是_____ 。
(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为_____ ;设晶胞参数为 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
 原子最外层电子的电子云轮廓图为
原子最外层电子的电子云轮廓图为A.球形 B.哑铃形
(2)下列电子排布式分别代表铍微粒,其中失去1个电子所需能量最多的是_____。
A.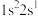 | B. | C.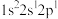 | D. |
(3)“固态双铍化合物的化学式为
A.极性键 B.非极性键 C.金属键 D.
 键
键(4)卤化铍的熔点如表所示:
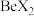 | 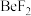 |  | 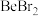 | 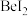 |
熔点/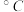 | 552 | 399 | 488 | 510 |
 中
中 原子的杂化方式为
原子的杂化方式为②
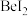
③
 、
、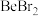 、
、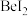 的熔点依次升高的原因是
的熔点依次升高的原因是(5)
 易形成配离子
易形成配离子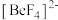 ,其中心阳离子的配位数为
,其中心阳离子的配位数为(6)离子晶体中稳定配位多面体的理论半径比如表所示:
| 配位多面体 | 配位数 | 半径比(r+/r-) |
| 平面三角形 | 3 | 0.15~0.225 |
| 四面体 | 4 | 0.225~0.414 |
| 八面体 | 6 | 0.414~0.732 |
| 立方体 | 8 | 0.732~1.000 |
| 立方八面体 | 12 | 1.000 |
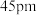 、
、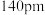 ,
, 的配位多面体是
的配位多面体是(7)Be的某种氧化物晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。这种氧化物的化学式为
 ,用
,用 表示阿伏加德罗参数的值,则
表示阿伏加德罗参数的值,则 晶体的密度为
晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。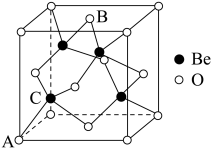
您最近一年使用:0次
2 . 工业用焦炭和硫酸钠反应制备硫化钠:Na2SO4 + 2C Na2S + CO2↑,完成下列填空:
Na2S + CO2↑,完成下列填空:
(1)硫元素在周期表中的位置为___________ ,硫原子核外有___________ 种不同运动状态的电子。
(2)CS2的结构与CO2相似,二者形成晶体时的熔点高低为:CS2___________ CO2(填“>、=、<”)。
(3)有关二硫化碳分子的描述正确的是______
(4)C元素和S元素比较,非金属性强的是___________ ,写出一个能支持你的结论的事实:___________ 。
(5)Na2S又称臭碱,Na2S溶液中含硫元素微粒的浓度由大到小的顺序是___________ 。
(6)天然气中常含有少量H2S,在酸性介质中进行天然气脱硫的原理示意图如图示,
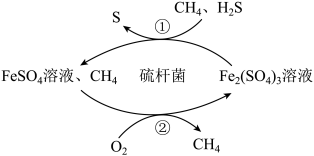
配平步骤①涉及到的方程式(先在括号里补齐生成物):_________
___________Fe2 (SO4)3 + ___________ H2S =___________ FeSO4 +___________ S↓ +___________
(7)图示中反应②是FeSO4在酸性条件下被O2氧化的过程,若有1摩尔FeSO4在酸性条件下被氧化,需要O2的体积(标准状况)为___________ 升。
 Na2S + CO2↑,完成下列填空:
Na2S + CO2↑,完成下列填空:(1)硫元素在周期表中的位置为
(2)CS2的结构与CO2相似,二者形成晶体时的熔点高低为:CS2
(3)有关二硫化碳分子的描述正确的是______
| A.含有非极性键 | B.是直线形分子 | C.属于极性分子 | D.结构式为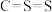 |
(5)Na2S又称臭碱,Na2S溶液中含硫元素微粒的浓度由大到小的顺序是
(6)天然气中常含有少量H2S,在酸性介质中进行天然气脱硫的原理示意图如图示,

配平步骤①涉及到的方程式(先在括号里补齐生成物):
___________Fe2 (SO4)3 + ___________ H2S =___________ FeSO4 +___________ S↓ +___________
(7)图示中反应②是FeSO4在酸性条件下被O2氧化的过程,若有1摩尔FeSO4在酸性条件下被氧化,需要O2的体积(标准状况)为
您最近一年使用:0次
名校
解题方法
3 . 锗、锡、铅均属于ⅣA族元素,它们的单质与化合物广泛应用于生活的各个领域。
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有_______ 个,它们运动所形成的电子云形状为_______ 形。
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由_______ 。氢化锗的液氨溶液具有较好的导电性,主要是因为GeH4与NH3反应生成了 和
和_______ (填化学式)两种离子。
Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH_______ (填“大于”“小于”或“等于”)后者。
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式_______ 。
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、 、
、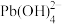 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。

(5)Pb(NO3)2溶液中,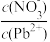
_______ 2(填“>”“=”或“<”);往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子除Na+外,还有_______ (填微粒符号)。
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq) D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为_______ (选填编号)。
a.4~5 b.6~7 c.8~10 d.12~14
Ⅰ.完成下列填空:
(1)锗元素原子核外能量最高的电子有
(2)氢化锗(GeH4)结构与甲烷类似,在常温常压下是具有刺激性气味的无色有毒气体。从结构角度比较GeH4与CH4沸点高低并说明理由
 和
和Ⅱ.三水锡酸钠(Na2SnO3·3H2O)是一种易溶于水的无色晶体,露置在空气中会逐渐转化成Na2CO3和Sn(OH)4。
(3)常温下,相同物质的量浓度的Na2SnO3溶液与Na2CO3溶液,前者pH
(4)写出三水锡酸钠露置在空气中发生反应的化学方程式
Ⅲ.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
 、
、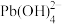 。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
。当总含铅量一定时,各形态铅的百分比(α)与溶液pH变化的关系如图所示。
(5)Pb(NO3)2溶液中,
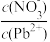
(6)科学家发现一种新型脱铅剂DH,能有效除去水中的痕量铅。已知DH脱铅过程中主要发生反应为:2DH(s)+Pb2+(aq)
 D2Pb(s)+2H+。则脱铅时最合适的pH约为
D2Pb(s)+2H+。则脱铅时最合适的pH约为a.4~5 b.6~7 c.8~10 d.12~14
您最近一年使用:0次
2022-05-29更新
|
274次组卷
|
4卷引用:上海市虹口区2022届高三下学期第二次模拟考试化学试题
上海市虹口区2022届高三下学期第二次模拟考试化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(结构与性质)江西省吉安市永丰县永丰中学2022-2023学年高二上学期1月期末化学(B班)试题
名校
解题方法
4 . 硼及其化合物在工业中有很多用处。一些硼的卤化物的沸点如图所示:
(1)硼原子的核外共有____ 种形状不同的电子云;溴原子的最外层电子排布式为____ 。
(2)表中三种卤化物分子的空间构型均为平面正三角形,由此推断F—B—F的键角为____ ,BF3属于____ 分子(填“极性”或“非极性”)。
(3)解释表中三种卤化硼沸点存在差异的原因____ 。
CS2是一种重要的化工原料。
(4)工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g),CS2的结构式为
CS2(g)+2H2S(g),CS2的结构式为____ ,利用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单质硫,可实现废物利用,保护环境,写出其中一个反应的化学方程式____ 。
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
(2)表中三种卤化物分子的空间构型均为平面正三角形,由此推断F—B—F的键角为
(3)解释表中三种卤化硼沸点存在差异的原因
CS2是一种重要的化工原料。
(4)工业上可以利用硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g)
 CS2(g)+2H2S(g),CS2的结构式为
CS2(g)+2H2S(g),CS2的结构式为
您最近一年使用:0次
5 . 镁元素在自然界分布广泛,是人体的必需元素之一。工业上可用硅热法(Pidgeon法)冶炼镁,以煅白(CaO·MgO,M = 96 g/mol)为原料与硅铁(含硅75%)混合置于密闭还原炉,1200℃下发生反应:2(CaO·MgO)(s) + Si(s)⇌Ca2SiO4 (l)+2Mg(g);完成下列填空:
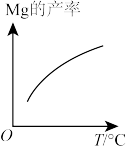
(1)已知还原性Mg > Si,上述反应仍能发生的原因是_______ 。
(2)由图推测上述反应正向为_______ (填“吸热”或“放热”)反应。
(3)若还原炉体积不变,能证明上述反应达到平衡的是_______ (选填序号)。
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将_______ (填“升高”“降低”或“不变”)。
(5)若还原炉容积为400 m3,原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率_______ mol/(L·h)。
(6)工业上也可用电解法来制备镁。相关化合物的熔点如表所示:
①镁原子核外有_______ 种能量不同的电子,它们的运动状态有_______ 种。
②MgCl2的电子式为_______ ;
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由_______
(1)已知还原性Mg > Si,上述反应仍能发生的原因是
(2)由图推测上述反应正向为

(3)若还原炉体积不变,能证明上述反应达到平衡的是
a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
(4)平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时Mg(g)的浓度将
(5)若还原炉容积为400 m3,原料中煅白质量为9600 kg,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率
(6)工业上也可用电解法来制备镁。相关化合物的熔点如表所示:
| MgCl2 | MgO | |
| 熔点/℃ | 712 | 2850 |
①镁原子核外有
②MgCl2的电子式为
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由
您最近一年使用:0次
解题方法
6 . SeO2是一种常见的氧化剂,易被还原成 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
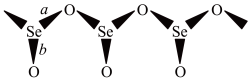
完成下列填空:
(1) 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为_______ ,原子核外占据最高能级的电子云形状为_______ 形。
(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式_______ 。
(3) SeO2属于_______ 晶体,其熔点远高于 的理由是
的理由是_______ 。解释键能 的原因
的原因_______ 。
(4) SeO2可将 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为_______ 。常温下,在稀溶液中硫酸的电离方式为: ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中, 的电离程度较大的是
的电离程度较大的是_______ ,两种溶液中 电离程度不同的原因是
电离程度不同的原因是_______ 。
 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
键长 | |
| a | 178 |
| b | 160.7 |
(1)
 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式
(3) SeO2属于
 的理由是
的理由是 的原因
的原因(4) SeO2可将
 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为 ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中, 的电离程度较大的是
的电离程度较大的是 电离程度不同的原因是
电离程度不同的原因是
您最近一年使用:0次
解题方法
7 . 元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(1)A的最外层电子轨道排布图为___ ;B的电子排布式为___ ;C的最外层电子排布式为__ ;D的原子结构示意图为___ 。
(2)D与H原子形成的某气态化合物溶于水能使酚酞溶液变红,请解释原因:__ 。已知D与H原子能形成一种高能量的分子D2H2,其中D原子满足8电子结构特征,则该分子的电子式为___ 。
(3)B的原子核外电子运动状态有__ 种,原子轨道数为__ ,有__ 种能量不同的电子,电子占据的最高能量的电子层符号为__ 。
(4)四种元素最高价氧化物水化物酸性由强到弱的是(用对应化学式回答)__ 。
(1)A的最外层电子轨道排布图为
(2)D与H原子形成的某气态化合物溶于水能使酚酞溶液变红,请解释原因:
(3)B的原子核外电子运动状态有
(4)四种元素最高价氧化物水化物酸性由强到弱的是(用对应化学式回答)
您最近一年使用:0次
8 . 铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_____ 种不同运动状态的电子,有_____ 种能量不同的电子。
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是______ 晶体,试比较组成该物质的两微粒半径大小____________________ 。
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
(4)氢氧化铝在水中发生酸式电离的电离方程式为:____________________ ,
滴入少量盐酸,上述体系中Al3+浓度_______ (填“增加”、“减少”或“不变”)。
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_______ (选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在________ 极可得金属铝的质量为__________ 克。工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因_____________________ 。
(1)铝原子核外有
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO
 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 a.Al活泼性大于Ba | b.Ba沸点比Al的低 | c.BaO·Al2O3比Al2O3稳定 |
滴入少量盐酸,上述体系中Al3+浓度
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在
您最近一年使用:0次



