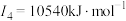名校
解题方法
1 . 现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A元素的核外电子数和电子层数相等,也是宇宙中含量最丰富的元素 |
B元素是形成化合物种类最多的元素 |
C元素基态原子的核外p电子数比s电子数少1 |
D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别如下:
|
F元素的主族序数与周期数的差为4 |
G元素是前四周期中电负性最小的元素 |
H元素位于元素周期表中的第八纵列 |
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)E元素基态原子的电离能I3远远大于I2,其原因是
(4)B、C、D、E四种元素的第一电离能由大到小的顺序是
(5)用惰性电极电解EF2的水溶液的离子方程式为
(6)H位于元素周期表中
您最近一年使用:0次
名校
2 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氨元素主要以分子的形式存在于空气中,是人工固氮的主要来源。基态氮原子核外电子最高能级的电子云轮廓图为_______ 形。
(2) 是
是____ (填“极性”或“非极性”)分子, 的键角
的键角_____ (填“>”或“<”)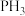 的键角。
的键角。
(3)纯叠氮酸 在常温下是一种液体,沸点较高,为
在常温下是一种液体,沸点较高,为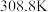 ,主要原因是
,主要原因是_______
(4)我国科研人员研制出了“ ”催化剂,将合成氨的温度、压强分别降到了
”催化剂,将合成氨的温度、压强分别降到了 、
、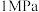 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。
①比较 与
与 的半径大小关系:
的半径大小关系: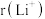
_______  (填“>”或“<”)。
(填“>”或“<”)。
② 的化合物
的化合物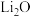 是离子化合物,下图是其
是离子化合物,下图是其 循环,表示其形成过程
循环,表示其形成过程
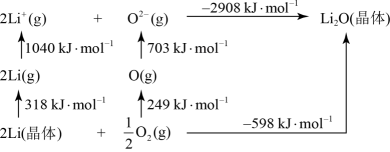
可知, 原子的第一电离能为
原子的第一电离能为_______  ,O=O键键能为
,O=O键键能为_______ 
(1)自然界中的氨元素主要以分子的形式存在于空气中,是人工固氮的主要来源。基态氮原子核外电子最高能级的电子云轮廓图为
(2)
 是
是 的键角
的键角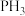 的键角。
的键角。(3)纯叠氮酸
 在常温下是一种液体,沸点较高,为
在常温下是一种液体,沸点较高,为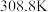 ,主要原因是
,主要原因是(4)我国科研人员研制出了“
 ”催化剂,将合成氨的温度、压强分别降到了
”催化剂,将合成氨的温度、压强分别降到了 、
、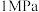 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。①比较
 与
与 的半径大小关系:
的半径大小关系: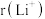
 (填“>”或“<”)。
(填“>”或“<”)。②
 的化合物
的化合物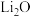 是离子化合物,下图是其
是离子化合物,下图是其 循环,表示其形成过程
循环,表示其形成过程
可知,
 原子的第一电离能为
原子的第一电离能为 ,O=O键键能为
,O=O键键能为
您最近一年使用:0次
2022-10-19更新
|
142次组卷
|
2卷引用:四川省绵阳市南山中学2022-2023学年高二上学期10月月考化学试题
解题方法
3 . John B.Goodenough等三位科学家因在发展锂离子电池方面做出的贡献而获得了诺贝尔化学奖。回答下列问题:
(1)锰酸锂( LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为_______ 。基态 Mn原子核外价层电子的运动状态有_______ 种。
(2)锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和POF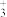 , PF
, PF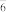 中心原子的价层电子对数为
中心原子的价层电子对数为_______ ,POF3的空间构型为_______ 。 下列对PF5中心原子杂化方式的推断合理的是_______ (填字母)。
A. sp2 B. sp3 C. sp3d D. sp3d2
(3)三元正极材料LiC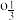 N
N jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe
jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe_______ (填“大于”或“小于”)Mn,原因是_______ 。
(4)链化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
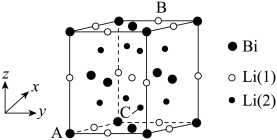
①晶施可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为_______ 。
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为_______ ,Bi与Li(1)和Li(2)之间的最短距离的比值为_______ 。
(1)锰酸锂( LiMn2O4)电池具有原料成本低合成工艺简单等优点。原子中运动的电子有两种相反的身旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Li原子,其核外电子自旋磁量子数的代数和为(2)锂离子电池的电解液一般为溶有LiPF6的碳酸酯类有机溶剂,LiPF6遇水反应生成PF3和POF
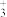 , PF
, PF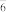 中心原子的价层电子对数为
中心原子的价层电子对数为A. sp2 B. sp3 C. sp3d D. sp3d2
(3)三元正极材料LiC
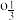 N
N jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe
jMnO2掺杂Al3+可使其性能更优,第三电离能:Fe(4)链化锂被认为是很有潜力的正极材料,晶胞结构如图所示。

①晶施可以看作是由铋原子构成的面心立方晶格,锂原子填充在其中的四面体和八面体空隙处,晶体的化学式为
②图中原子坐标参数:A为(0,0,0),B为(1,0.5,1),则C的坐标为
您最近一年使用:0次
名校
解题方法
4 . 过渡金属及其化合物在生产、生活中有重要的应用,回答下列问题:
(1)基态Cu+核外电子的空间运动状态有_______ 种。
(2)N2H4分子的结构式为_______ ,其中N采取_______ 杂化。N2H4和NH2OH都能结合H+而显弱碱性,但是NH2OH的碱性比N2H4弱,请解释其原因:_______ 。
(3)N2O5常温下为白色固体,是一种离子晶体,以NO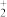 和NO
和NO 的形式结合,其中NO
的形式结合,其中NO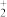 的空间构型为
的空间构型为_______ 。已知某配合物[Cr(OH)3(H2O)(en)] (en为H2NCH2CH2NH2),中心粒子Cr与所有O、N均形成了配位键),则1mol该配合物中含_______ mol σ键。
(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如图所示。

①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、B( ,
, ,0)、C(1,
,0)、C(1, ,
, ),则此晶胞中,距离A球最远的黑球的坐标参数为
),则此晶胞中,距离A球最远的黑球的坐标参数为_______ 。
②若砷和镓的原子半径分别为a cm和b cm,砷化镓的摩尔质量为M g/mol,密度为ρ g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为ω,则阿伏加德罗常数为_______ mol-1。
(1)基态Cu+核外电子的空间运动状态有
(2)N2H4分子的结构式为
(3)N2O5常温下为白色固体,是一种离子晶体,以NO
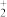 和NO
和NO 的形式结合,其中NO
的形式结合,其中NO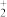 的空间构型为
的空间构型为(4)2011年,我国将镓列为战略储备金属,我国的镓储量约占世界储量的80%以上。砷化镓也是半导体材料,其结构与硫化锌类似,其晶胞结构如图所示。

①原子坐标参数是晶胞的基本要素之一,表示晶胞内部各原子的相对位置。图中A(0,0,0)、B(
 ,
, ,0)、C(1,
,0)、C(1, ,
, ),则此晶胞中,距离A球最远的黑球的坐标参数为
),则此晶胞中,距离A球最远的黑球的坐标参数为②若砷和镓的原子半径分别为a cm和b cm,砷化镓的摩尔质量为M g/mol,密度为ρ g/cm3,晶胞中原子体积占空间体积百分率(即原子体积的空间占有率)为ω,则阿伏加德罗常数为
您最近一年使用:0次
5 . 下表为周期表的一部分,其中的编号代表所对应的元素。

请回答下列问题:
(1)表中属于d区的元素是___________ (填编号)。
(2)元素⑨的基态原子有___________ 种运动状态不相同的电子。
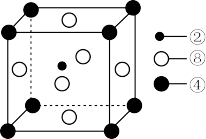
(3)科学研究发现,②、④、⑧三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示,则该化合物的化学式为___________ (用对应的元素符号表示),1个④与___________ 个⑧等距离且最近。
(4)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是___________ 。
a.该分子属于含有极性键的非极性分子
b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化
(5)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为________ ,写出该过程中沉淀溶解的离子方程式________ 。
(6)第一电离能④_________ ⑤(填“>”、“<”或“=”),其原因是__________ 。

请回答下列问题:
(1)表中属于d区的元素是
(2)元素⑨的基态原子有
(3)科学研究发现,②、④、⑧三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示,则该化合物的化学式为

(4)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是
a.该分子属于含有极性键的非极性分子
b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化
(5)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为
(6)第一电离能④
您最近一年使用:0次
名校
解题方法
6 . 中科院陈创天院士首创的 晶体在激光技术领域具有重要应用价值,
晶体在激光技术领域具有重要应用价值, 的化学组成为
的化学组成为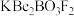 ;中科院福建物构所科研人员研制的
;中科院福建物构所科研人员研制的 晶体具备更优应用潜质,
晶体具备更优应用潜质, 的化学组成为
的化学组成为 。
。
(1) 是第5周期、ⅡA族元素,
是第5周期、ⅡA族元素, 的价电子层排布式为
的价电子层排布式为_______ 。
(2) 晶体可将入射激光直接倍频产生深紫外激光,源于
晶体可将入射激光直接倍频产生深紫外激光,源于_______ (填选项符号)
A. 分子热效应 B. 晶体内化学反应焓变 C. 原子核外电子在能级间的跃迁
(3) 晶体生产原料纯化过程重要物质乙酸氧铍
晶体生产原料纯化过程重要物质乙酸氧铍 分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:

①分子中碳原子杂化类型为_______ 。
②六个甲基中的碳原子形成的空间构型为_______ 。
③乙酸氧铍晶体中微粒间作用力包括_______ (填选项符号)。
A. 离子键 B. 金属键 C. 配位键 D. 范德华力 E. 非极性键 F. 氢键
(4)一定条件下,超氧化钾(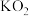 )晶体呈如图立方体结构。若邻近钾原子核间距为
)晶体呈如图立方体结构。若邻近钾原子核间距为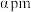 、阿伏加德罗常数为
、阿伏加德罗常数为 ,则晶体密度为
,则晶体密度为_______ 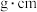 。
。

 晶体在激光技术领域具有重要应用价值,
晶体在激光技术领域具有重要应用价值, 的化学组成为
的化学组成为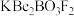 ;中科院福建物构所科研人员研制的
;中科院福建物构所科研人员研制的 晶体具备更优应用潜质,
晶体具备更优应用潜质, 的化学组成为
的化学组成为 。
。(1)
 是第5周期、ⅡA族元素,
是第5周期、ⅡA族元素, 的价电子层排布式为
的价电子层排布式为(2)
 晶体可将入射激光直接倍频产生深紫外激光,源于
晶体可将入射激光直接倍频产生深紫外激光,源于A. 分子热效应 B. 晶体内化学反应焓变 C. 原子核外电子在能级间的跃迁
(3)
 晶体生产原料纯化过程重要物质乙酸氧铍
晶体生产原料纯化过程重要物质乙酸氧铍 分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
①分子中碳原子杂化类型为
②六个甲基中的碳原子形成的空间构型为
③乙酸氧铍晶体中微粒间作用力包括
A. 离子键 B. 金属键 C. 配位键 D. 范德华力 E. 非极性键 F. 氢键
(4)一定条件下,超氧化钾(
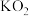 )晶体呈如图立方体结构。若邻近钾原子核间距为
)晶体呈如图立方体结构。若邻近钾原子核间距为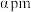 、阿伏加德罗常数为
、阿伏加德罗常数为 ,则晶体密度为
,则晶体密度为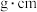 。
。
您最近一年使用:0次
2021-04-10更新
|
404次组卷
|
3卷引用:四川省成都市实验中学2021-2022学年高三下学期2月月考理科综合化学试题
解题方法
7 . 叶绿素是绿色植物进行光合作用所必需的催化剂,其结构如图所示。
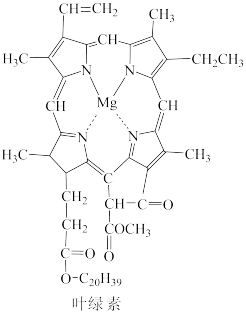
(1)基态镁原子中电子占据的轨道数为___________ ,能量最高的电子占据的轨道呈___________ 形。根据对角线规则,Mg的一些化学性质与元素___________ 相似。
(2)C、N、O三种非金属元素的第一电离能大小顺序是___________ 。
(3)叶绿素分子中,Mg2+与其周围的四个N形成两种不同类型的化学键,分别是___________ ,N原子的杂化类型是___________ 。
(4)Mg2+与Zn2+具有各电子层全满的相似结构,但Zn2+形成的配合物比Mg2+形成的配合物稳定。请说明原因___________ 。
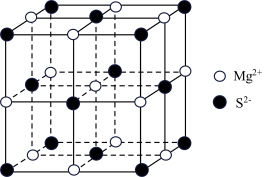
(5)MgS具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgS的晶胞参数为0.52 nm,则S2-半径为___________ (保留两位有效数字),晶体密度是___________ g·cm-3.(设NA为阿伏加德罗常数的值,列出计算式)

(1)基态镁原子中电子占据的轨道数为
(2)C、N、O三种非金属元素的第一电离能大小顺序是
(3)叶绿素分子中,Mg2+与其周围的四个N形成两种不同类型的化学键,分别是
(4)Mg2+与Zn2+具有各电子层全满的相似结构,但Zn2+形成的配合物比Mg2+形成的配合物稳定。请说明原因
(5)MgS具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgS的晶胞参数为0.52 nm,则S2-半径为

您最近一年使用:0次
8 . 按要求回答下列问题:
(1)某元素原子的价电子排布式为3d14s2,元素符号为________ ,最高正化合价为________ 。
(2)原子序数为26的元素的原子中有________ 个能级,________ 个未成对电子,________ 种运动状态不同的电子,位于________ 族________ 区,该原子的原子结构示意图为________ 。
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为________ ,其能量最高的电子的电子云在空间有________ 个方向,原子轨道呈________ 形。
(4)请写出次外层电子数是最外层电子数 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:____________ 。
(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是________ 。
(1)某元素原子的价电子排布式为3d14s2,元素符号为
(2)原子序数为26的元素的原子中有
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为
(4)请写出次外层电子数是最外层电子数
 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是
您最近一年使用:0次
名校
解题方法
9 . 含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为_____ ;基态Cu+的核外电子排布式为_____ 。
(2)化合物(CH3)3N分子中N原子杂化方式为_____ ,该物质能溶于水的原因是_____ 。
(3)PH3分子的键角小于NH3分子的原因是_____ ;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为_____ 。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
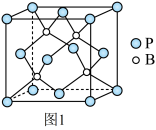
①在一个晶胞中磷原子的配位数为_____ 。
②已知磷化硼晶体的密度为ρg/cm3,阿伏加 德罗常数为NA,则B-P键长为_____ 。
(1)基态B原子电子占据最高能级的电子云轮廓图为
(2)化合物(CH3)3N分子中N原子杂化方式为
(3)PH3分子的键角小于NH3分子的原因是
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:

①在一个晶胞中磷原子的配位数为
②已知磷化硼晶体的密度为ρg/cm3,阿伏加 德罗常数为NA,则B-P键长为
您最近一年使用:0次
解题方法
10 . 镓(31Ga)是一种重要金属元素,镓及其化合物在电子工业、光电子工业、国防工业和超导材料等领域有着广泛的应用。回答下列问题:
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为__________ ,未成对电子数为________________ 。
(2)Ga(NO3)3中阴离子的立体构型是_____________ ,写出一个与该阴离子的立体构型相同的分子的化学式___________ 。
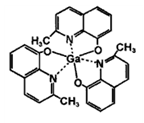
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是____________________________ (填元素符号),提供孤电子对的成键原子是_____________ 。
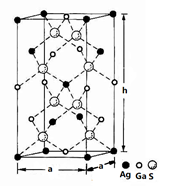
(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为___________ ,晶胞底面的边长a=5.75 nm,高h=10.30nm,该晶体密度为__________________ g·cm-3(列出计算式即可)。
(1)基态Ga原子占据最高能级电子的电子云轮廓图形状为
(2)Ga(NO3)3中阴离子的立体构型是
(3)2-甲基-8-羟基喹啉镓(如图)应用于分子印迹技术,2-甲基-8-羟基喹啉镓中五种元素电负性由大到小的顺序是

(4)一种硅镓半导体材料的晶胞结构如图所示由硫、镓、银形成的化合物的晶胞是底面为正方形的长方体,结构如下图所示,则该晶体中硫的配位数为

您最近一年使用:0次
2018-04-28更新
|
347次组卷
|
2卷引用:四川省宜宾市叙州区第二中学校2020届高三上学期期末考试理综化学试题

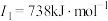 ,
,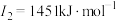 ,
,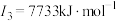 ,
,