1 . 回答下列问题
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为___________ ,电负性O___________ F;其中氧原子的杂化方式为___________ 。
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。 空间结构是
空间结构是___________ ;X与Z形成化合物中含有的化学键是___________ 。
(3) 的空间结构为
的空间结构为___________ 。(用文字描述,下同): 的空间结构是
的空间结构是___________ 。
(4)在BF3分子中: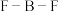 的键角是
的键角是___________ ,B原子的杂化轨道类型为___________ ,BF3和过量NaF作用可生成NaBF4, 的空间结构为
的空间结构为___________ 。
(5)钠在火焰上灼烧产生的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为___________ ;其中π键与σ键的个数比为___________ 。
(7)基态S原子价电子排布式___________ ;S原子的核外电子运动状态有___________ 种,空间运动状态有___________ 种:能量最高的轨道的电子云的形状是___________ 。
(1)F2通入稀NaOH溶液中可生成OF2,OF2空间结构为
(2)X、Y、Z为短周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成NH3;Z基态原子的M层与K层电子数相等。
 空间结构是
空间结构是(3)
 的空间结构为
的空间结构为 的空间结构是
的空间结构是(4)在BF3分子中:
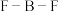 的键角是
的键角是 的空间结构为
的空间结构为(5)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(6)已知(CN)2是直线形分子,且有对称性,则(CN)2分子的结构式为
(7)基态S原子价电子排布式
您最近一年使用:0次
2024-02-22更新
|
222次组卷
|
3卷引用:天津市耀华中学2023-2024学年高二上学期1月期末化学试题
2 . 磷酸亚铁锂( )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:
(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为________ 形。
(2)Fe元素位于周期表_____ 周期_____ 族;原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为___________ 。
(3)基态Mn2+的价电子排布式为___________ ,锰的第三电离能高于铁的第三电离能,其原因是___________ 。
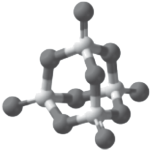
(4)P4S10的分子结构如图所示,其中含有________ 个六元环;______ g P4S10含有8molσ键。
 )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为
(2)Fe元素位于周期表
 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为(3)基态Mn2+的价电子排布式为
(4)P4S10的分子结构如图所示,其中含有
您最近一年使用:0次
2023-12-26更新
|
155次组卷
|
4卷引用:名校期中好题汇编-分子结构与性质(非选择题)
3 . 根据有关知识,回答下列问题。
(1)符号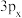 所代表的含义是_______(填字母)。
所代表的含义是_______(填字母)。
(2)铝原子核外电子云有_______ 种不同的伸展方向,有_______ 种不同运动状态的电子。
(3)短周期的化学元素(0族和放射性元素除外)中,第一电离能最小的元素是_______ (填元素符号,下同),电负性最大的元素是_______ 。
(4)Be的第一电离能大于B的第一电离能,这是因为_______ 。
(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:_______ 。
(6)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
锰元素位于第四周期第ⅦB族。请写出基态 的价层电子排布式:
的价层电子排布式:_______ ,比较两元素的 、
、 ,可知,气态
,可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是_______ 。
(1)符号
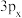 所代表的含义是_______(填字母)。
所代表的含义是_______(填字母)。A.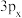 轨道上有3个电子 轨道上有3个电子 |
B.第3个电子层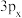 轨道有三个伸展方向 轨道有三个伸展方向 |
C.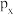 电子云有3个伸展方向 电子云有3个伸展方向 |
| D.第3个电子层沿x轴方向伸展的p轨道 |
(3)短周期的化学元素(0族和放射性元素除外)中,第一电离能最小的元素是
(4)Be的第一电离能大于B的第一电离能,这是因为
(5)短周期元素中符合“对角线规则”的元素有Be和Al、B和Si,它们的性质分别有一定的相似性,写出
 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:(6)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下表所示:
| 元素 | Mn | Fe | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
锰元素位于第四周期第ⅦB族。请写出基态
 的价层电子排布式:
的价层电子排布式: 、
、 ,可知,气态
,可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子难,对此你的解释是
再失去1个电子难,对此你的解释是
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)基态B原子的核外电子有_______ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为_______ 。
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因_______ ,BF3中B原子的杂化方式为_______ 。
(3)在石墨转化成金刚石的过程中,下列说法正确的是_______。
(4)铁酸钇是一种典型的单相多铁性材料其正交相晶胞结构如图所示。
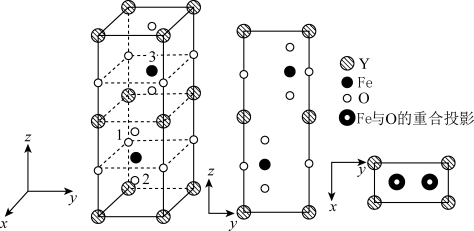
其中铁酸钇的化学式为_______ ,已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, -m,
-m, -n),则3号Fe原子的空间坐标为
-n),则3号Fe原子的空间坐标为_______ ,若晶胞参数分别为a pm、b pm和c pm,阿伏加德罗常数的值用NA表示,则该晶体的密度为_______  (列出表达式)
(列出表达式)
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
(3)在石墨转化成金刚石的过程中,下列说法正确的是_______。
| A.碳原子的杂化方式发生变化 | B.碳碳键的键能不变 |
| C.原子间成键方式未改变 | D.反应前后,物质的物理性质不变 |

其中铁酸钇的化学式为
 ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, -m,
-m, -n),则3号Fe原子的空间坐标为
-n),则3号Fe原子的空间坐标为 (列出表达式)
(列出表达式)
您最近一年使用:0次
解题方法
5 .  是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用
是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用 标准溶液标定未知浓度的
标准溶液标定未知浓度的 溶液,发生反应:
溶液,发生反应:
 。
。
根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的___________ 区,元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为___________  (填标号)。
(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)1
 中所含有的共价键数目为
中所含有的共价键数目为___________ 。
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为___________ , 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是___________ 。
(4)同主族元素氧、硫、硒对应简单氢化物的沸点: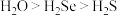 ,原因是
,原因是___________ 。
(5) 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。

① 中
中 的配位数为
的配位数为___________ 。
②若该晶体的晶胞参数为 ,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为
,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为___________  ,
, 的密度
的密度
___________  (列出表达式)。
(列出表达式)。
 是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用
是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应。实验室常用 标准溶液标定未知浓度的
标准溶液标定未知浓度的 溶液,发生反应:
溶液,发生反应:
 。
。根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的
 (填标号)。
(填标号)。A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)1

 中所含有的共价键数目为
中所含有的共价键数目为(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为
 中碳原子的轨道杂化类型是
中碳原子的轨道杂化类型是(4)同主族元素氧、硫、硒对应简单氢化物的沸点:
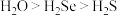 ,原因是
,原因是(5)
 的结构中
的结构中 为面心立方最密堆积,晶胞结构如图所示。
为面心立方最密堆积,晶胞结构如图所示。
①
 中
中 的配位数为
的配位数为②若该晶体的晶胞参数为
 ,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为
,阿伏加德罗常数的值为NA。则距离最近的两个锰原子之间的距离为 ,
, 的密度
的密度
 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
解题方法
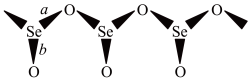
6 . SeO2是一种常见的氧化剂,易被还原成 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
完成下列填空:
(1) 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为_______ ,原子核外占据最高能级的电子云形状为_______ 形。
(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式_______ 。
(3) SeO2属于_______ 晶体,其熔点远高于 的理由是
的理由是_______ 。解释键能 的原因
的原因_______ 。
(4) SeO2可将 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为_______ 。常温下,在稀溶液中硫酸的电离方式为: ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中, 的电离程度较大的是
的电离程度较大的是_______ ,两种溶液中 电离程度不同的原因是
电离程度不同的原因是_______ 。
 。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
。根据X射线衍射分析,SeO2晶体是如下图所示的长链状结构:
键长 | |
| a | 178 |
| b | 160.7 |
(1)
 与S同属于VIA族,该族元素原子最外层电子的轨道表示式为
与S同属于VIA族,该族元素原子最外层电子的轨道表示式为(2) SeO2在315℃时升华,蒸气中存在二聚态的SeO2,红外研究表明,二聚态的SeO2结构中存在四元环,写出该二聚态的结构式
(3) SeO2属于
 的理由是
的理由是 的原因
的原因(4) SeO2可将
 的水溶液氧化成
的水溶液氧化成 ,反应的化学方程式为
,反应的化学方程式为 ;
; 。则在相同浓度
。则在相同浓度 与
与 的稀溶液中,
的稀溶液中, 的电离程度较大的是
的电离程度较大的是 电离程度不同的原因是
电离程度不同的原因是
您最近一年使用:0次
7 . 合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。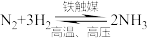
(1)基态氢原子中,核外电子的电子云轮廓图形状为_______
(2)自然界中的复元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为_______
② 分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
分子中,与N原子相连的H显正电性。N、H电负性大小顺序为_______ 。
(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有 、
、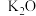 、
、 、
、 、
、 等氧化物中的几种。
等氧化物中的几种。
①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是_______ 。
②比较 、
、 第一电高能的大小:
第一电高能的大小:_______
③表中的数据从上到下是纳、镁、铝逐级失去电子的电离能。
为什么原子的逐级电高能越来越大?______ ;结合数据说明为什么 的常见化合价为
的常见化合价为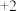 价:请解释之:
价:请解释之:_______ 。
(4)目前合成氨通常采用的压强为 温度为
温度为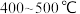 ,十分耗能。我国科研人员研制出了“
,十分耗能。我国科研人员研制出了“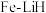 ”等催化剂,温度、压强分别降到了350℃、
”等催化剂,温度、压强分别降到了350℃、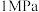 ,这是近年来合成纸反应研究中的重要突破。
,这是近年来合成纸反应研究中的重要突破。
①基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
②比较 与
与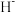 的半径大小关系:
的半径大小关系:
_______ 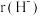 (填“>”或“<”)。
(填“>”或“<”)。
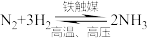
(1)基态氢原子中,核外电子的电子云轮廓图形状为
(2)自然界中的复元素主要以分子的形式存在于空气中,是人工固氮的主要来源。
①基态氮原子的轨道表示式为
②
 分子中,与N原子相连的H显正电性。N、H电负性大小顺序为
分子中,与N原子相连的H显正电性。N、H电负性大小顺序为(3)铁触媒是普遍使用的以铁为主体的多成分催化剂,通常还含有
 、
、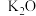 、
、 、
、 、
、 等氧化物中的几种。
等氧化物中的几种。①上述氧化物所涉及的元素中,处于元素周期表中p区的元素是
②比较
 、
、 第一电高能的大小:
第一电高能的大小:③表中的数据从上到下是纳、镁、铝逐级失去电子的电离能。
| 元素 |  |  |  |
电离能(kJ mol-1) mol-1) | 496 | 738 | 578 |
| 4562 | 1451 | 1817 | |
| 6912 | 7733 | 2745 | |
| 9543 | 10540 | 11575 |
 的常见化合价为
的常见化合价为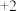 价:请解释之:
价:请解释之:(4)目前合成氨通常采用的压强为
 温度为
温度为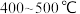 ,十分耗能。我国科研人员研制出了“
,十分耗能。我国科研人员研制出了“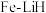 ”等催化剂,温度、压强分别降到了350℃、
”等催化剂,温度、压强分别降到了350℃、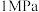 ,这是近年来合成纸反应研究中的重要突破。
,这是近年来合成纸反应研究中的重要突破。①基态
 原子的核外电子排布式为
原子的核外电子排布式为②比较
 与
与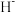 的半径大小关系:
的半径大小关系:
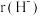 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
2021-01-24更新
|
364次组卷
|
4卷引用:北京市朝阳区2020-2021学年高二上学期期末质量检测化学试题
北京市朝阳区2020-2021学年高二上学期期末质量检测化学试题(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版选修3)2月刊 (同步课堂必刷题)(已下线)专题二 原子结构与元素的性质-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修2)2月刊 (同步课堂必刷题)(已下线)1.2 原子结构与元素的性质(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)
解题方法
8 . 碱金属及其化合物在生活、科研等领域用途广泛。回答下面相关问题:
(1)基态K原子核外有_______ 种不同的电子运动状态;下列碱金属原子核外电子发生如下变化时有可能会观察到焰色的是_______ (填字母代号)。
a.[Ar]4s1→[Ar]4p1
b.[Ne]3d1→[Ne]3s1
c.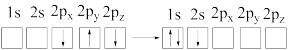
d.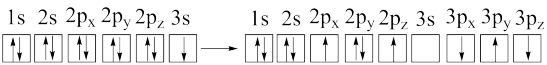
(2)碱金属易形成各种不同的盐,已知碱金属各种盐的沸点(℃)如表所示。
由此可以得出随质子数递增,碱金属形成化合物中化学键的离子性_______ (填“逐渐增强”“不变”或“逐渐减弱”);在硫酸盐和碳酸盐中,S,C原子的杂化形式分别为_______ 和_______ 。
(3)碱金属元素中,仅有Li可以直接与N2化合生成Li3N。已知该晶体中。存在锂、氮原子共同组成的锂、氮层,如图所示。

该结构中,在锂、氮层之间还应存在_______ (填“锂”或“氮”)层。理由是_______ 。
(4)氮化钼是制备锂离子电池的重要原材料,该晶胞结构如图所示。
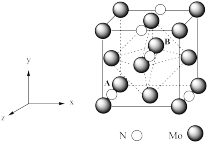
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若A的原子分数坐标为(0,0,0),则B的原子分数坐标为_______ 。
②N原子位于Mo原子立方晶格的_______ (填“四面体”“正方体”或“八面体”)空隙中,若Li位于该晶胞的八面体空隙中,则一个晶胞中最多能够填入_______ 个Li。
③若氮化钼的密度为 g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为
g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为_______ nm。(用含有 ,NA的代数式表示。设NA表示阿伏加德罗常数的值)
,NA的代数式表示。设NA表示阿伏加德罗常数的值)
(1)基态K原子核外有
a.[Ar]4s1→[Ar]4p1
b.[Ne]3d1→[Ne]3s1
c.

d.
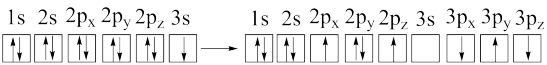
(2)碱金属易形成各种不同的盐,已知碱金属各种盐的沸点(℃)如表所示。
| Li | Na | K | |
| 氧化物 | 613 | 801 | 771 |
| 硫酸盐 | 859 | 880 | 1069 |
| 碳酸盐 | 720 | 858 | 901 |
由此可以得出随质子数递增,碱金属形成化合物中化学键的离子性
(3)碱金属元素中,仅有Li可以直接与N2化合生成Li3N。已知该晶体中。存在锂、氮原子共同组成的锂、氮层,如图所示。

该结构中,在锂、氮层之间还应存在
(4)氮化钼是制备锂离子电池的重要原材料,该晶胞结构如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若A的原子分数坐标为(0,0,0),则B的原子分数坐标为
②N原子位于Mo原子立方晶格的
③若氮化钼的密度为
 g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为
g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为 ,NA的代数式表示。设NA表示阿伏加德罗常数的值)
,NA的代数式表示。设NA表示阿伏加德罗常数的值)
您最近一年使用:0次
名校
解题方法
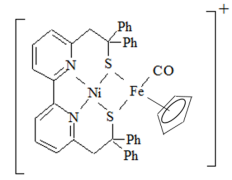
9 . (1)Ni2+和Fe2+可形成如图所示的配合物离子,其中铁的一个配体为茂环阴离子( ),该配体以π电子参与配位,其中Ni2+的价电子排布式为
),该配体以π电子参与配位,其中Ni2+的价电子排布式为______ ,配合物离子中铁周围的价电子数共有______ 个,S元素的杂化方式为______ ,该配合物离子中的 (Ⅰ)和气态
(Ⅰ)和气态 分子(Ⅱ)的三键相比,键长较长的为
分子(Ⅱ)的三键相比,键长较长的为______ (用Ⅰ或Ⅱ表示)。
(2)CsAuCl3的结构不能表示为CsCl·AuCl2,实际上可看作一种阳离子和两种阴离子按照个数比为2∶1∶1形成的,这两种阴离子形状分别是直线型和平面正方形,在平面正方形离子中Au的化合价为______ 。基态Cs原子中电子占据的能量最高的轨道是______ ,能量最低的空轨道是______ 。
(3)如果m个原子有相互平行的p轨道,这些p轨道中共有n个电子(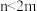 ),则可以形成大π键,表示为
),则可以形成大π键,表示为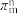 ,则SO2分子中的大π键可以表示为
,则SO2分子中的大π键可以表示为______ 。
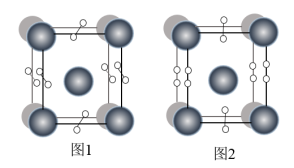
(4)如图表示的是某物质的两种结构的晶胞(大球表示的是K原子,小球表示O原子)图1中的O2单元空间取向有______ 种。若K之间底面上的最近距离为a pm,竖直方向上为c pm,图2表示的晶体密度为______  ,(NA表示阿伏加德罗常数)
,(NA表示阿伏加德罗常数)
 ),该配体以π电子参与配位,其中Ni2+的价电子排布式为
),该配体以π电子参与配位,其中Ni2+的价电子排布式为 (Ⅰ)和气态
(Ⅰ)和气态 分子(Ⅱ)的三键相比,键长较长的为
分子(Ⅱ)的三键相比,键长较长的为
(2)CsAuCl3的结构不能表示为CsCl·AuCl2,实际上可看作一种阳离子和两种阴离子按照个数比为2∶1∶1形成的,这两种阴离子形状分别是直线型和平面正方形,在平面正方形离子中Au的化合价为
(3)如果m个原子有相互平行的p轨道,这些p轨道中共有n个电子(
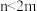 ),则可以形成大π键,表示为
),则可以形成大π键,表示为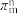 ,则SO2分子中的大π键可以表示为
,则SO2分子中的大π键可以表示为(4)如图表示的是某物质的两种结构的晶胞(大球表示的是K原子,小球表示O原子)图1中的O2单元空间取向有
 ,(NA表示阿伏加德罗常数)
,(NA表示阿伏加德罗常数)
您最近一年使用:0次
2021-01-03更新
|
582次组卷
|
4卷引用:八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)
八省八校(T8联考)2020-2021学年高三上学期第一次联考化学试题(华中师大一附中)(已下线)大题08 物质结构与性质(一)(选修)-【考前抓大题】备战2021年高考化学(全国通用)山东省菏泽市单县第二中学2023届高三第一次模拟考试化学试题湖南省常德市汉寿县第一中学2022届高三下学期第三次模考化学试题
10 . 按要求回答下列问题:
(1)某元素原子的价电子排布式为3d14s2,元素符号为________ ,最高正化合价为________ 。
(2)原子序数为26的元素的原子中有________ 个能级,________ 个未成对电子,________ 种运动状态不同的电子,位于________ 族________ 区,该原子的原子结构示意图为________ 。
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为________ ,其能量最高的电子的电子云在空间有________ 个方向,原子轨道呈________ 形。
(4)请写出次外层电子数是最外层电子数 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:____________ 。
(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是________ 。
(1)某元素原子的价电子排布式为3d14s2,元素符号为
(2)原子序数为26的元素的原子中有
(3)请写出有2个能层且p轨道中只有一对成对电子的基态原子的外围电子排布图为
(4)请写出次外层电子数是最外层电子数
 的元素的基态原子的电子排布式:
的元素的基态原子的电子排布式:(5)1~36号元素原子核外电子排布中未成对电子数最多的元素名称是
您最近一年使用:0次



