名校
1 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有____ 种不同能量的电子,具有_____ 种不同空间运动状态的电子,具有____ 种不同运动状态的电子。
(3)基态Cr原子的简化电子排布式为_________ ,基态Se原子的价电子轨道表示式为______ 。
(4)元素Cu在元素周期表中的位置_____ ,属于_____ 区,化合物 在加热条件下容易转化为
在加热条件下容易转化为 ,从原子结构的角度解释原因
,从原子结构的角度解释原因___________ 。
(5) 是离子晶体,其形成过程中的能量变化如图所示。
是离子晶体,其形成过程中的能量变化如图所示。
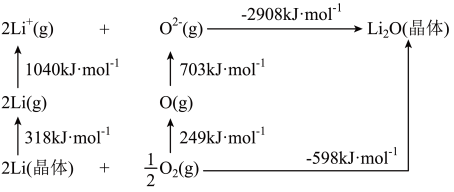
可知,Li原子的第一电离能为____  ,
, 键键能为
键键能为_____  。
。
(1)下列有关说法错误的是___________。
A.简单离子的还原性: |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(2)基态V原子中具有
(3)基态Cr原子的简化电子排布式为
(4)元素Cu在元素周期表中的位置
 在加热条件下容易转化为
在加热条件下容易转化为 ,从原子结构的角度解释原因
,从原子结构的角度解释原因(5)
 是离子晶体,其形成过程中的能量变化如图所示。
是离子晶体,其形成过程中的能量变化如图所示。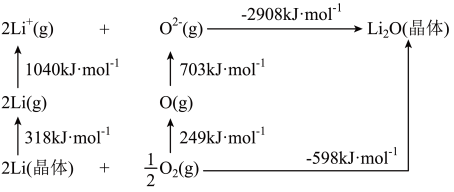
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为 。
。
您最近一年使用:0次
名校
解题方法
2 . 按要求完成下列填空:
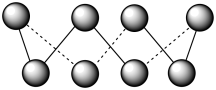
(1)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为_______ 。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为_______ 。S8易溶于二硫化碳的原因是_______ 。
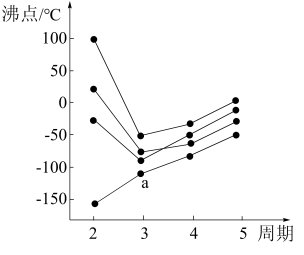
(2)如下图所示,每条折线表示周期表IVA~VIIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______ 。
(1)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为

(2)如下图所示,每条折线表示周期表IVA~VIIIA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

您最近一年使用:0次
名校
3 . 钛(22Ti)和钛的合金大量用于航空工业,有“空间金属”之称,制备钛的一种流程如下。
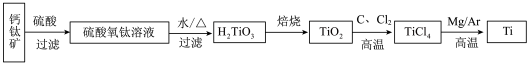
(1)基态Ti原子核外有_______ 种运动状态不同的电子
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。

化合物乙的沸点明显高于化合物甲,主要原因是_______ 。
(3)SO 的VSEPR模型名称为
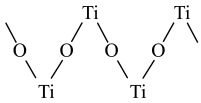
的VSEPR模型名称为_______ ,硫酸氧钛晶体中,阳离子为链状聚合形式的离子,结构如图所示,则硫酸氧钛化学式为_______ 。
(4)如图是硫的四种含氧酸根的结构,根据组成和结构推断,能在酸性溶液中能将Mn2+转化为MnO 的是_______(填标号)。
的是_______(填标号)。

(1)基态Ti原子核外有
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。

化合物乙的沸点明显高于化合物甲,主要原因是
(3)SO
 的VSEPR模型名称为
的VSEPR模型名称为
(4)如图是硫的四种含氧酸根的结构,根据组成和结构推断,能在酸性溶液中能将Mn2+转化为MnO
 的是_______(填标号)。
的是_______(填标号)。A. | B.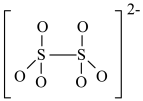 |
C.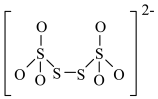 | D.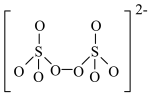 |
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题:
(1)基态B原子的核外电子有_______ 种空间运动状态;基态Ni原子核外占据最高能层电子的电子云轮廓图的形状为_______ 。
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因_______ ,BF3中B原子的杂化方式为_______ 。
(3)在石墨转化成金刚石的过程中,下列说法正确的是_______。
(4)铁酸钇是一种典型的单相多铁性材料其正交相晶胞结构如图所示。
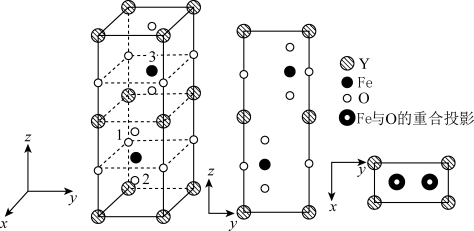
其中铁酸钇的化学式为_______ ,已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, -m,
-m, -n),则3号Fe原子的空间坐标为
-n),则3号Fe原子的空间坐标为_______ ,若晶胞参数分别为a pm、b pm和c pm,阿伏加德罗常数的值用NA表示,则该晶体的密度为_______  (列出表达式)
(列出表达式)
(1)基态B原子的核外电子有
(2)硼的卤化物的沸点如表所示:解释表中卤化物之间沸点差异的原因
| 卤化物 | BF3 | BCl3 | BBr3 |
| 沸点/℃ | -100.3 | 12.5 | 90 |
(3)在石墨转化成金刚石的过程中,下列说法正确的是_______。
| A.碳原子的杂化方式发生变化 | B.碳碳键的键能不变 |
| C.原子间成键方式未改变 | D.反应前后,物质的物理性质不变 |

其中铁酸钇的化学式为
 ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, -m,
-m, -n),则3号Fe原子的空间坐标为
-n),则3号Fe原子的空间坐标为 (列出表达式)
(列出表达式)
您最近一年使用:0次
名校
解题方法
5 . 碳和硅在元素周期表中都处于第ⅣA族,但他们的性质并不相同,碳和硅的性质差异清晰地显示出它们各自在有机化学和无机化学(硅酸盐)中占据统治地位的作用。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___ 形象化描述,基态硅原子的核外电子排布式为___ ,其基态原子核外有___ 种不同空间运动状态的电子。
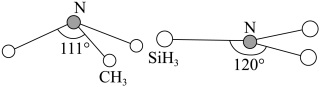
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为___ 。更易形成配合物的是___ 。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同。
第IIA族部分碳酸盐受热分解温度
试解释,ⅡA族碳酸盐的分解温度随着阳离子半径的增大逐步升高的原因___ 。
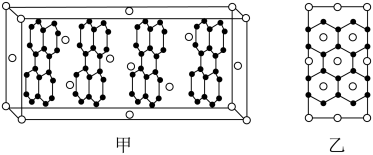
(4)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为___ 。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用
(2)由于硅的价层有d轨道可以利用,而碳没有,因此它们的化合物结构和性质存在较大差异。化合物N(CH3)3(三角锥形)和N(SiH3)3(平面形)的结构如图所示,则二者中N的杂化方式分别为

(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同。
第IIA族部分碳酸盐受热分解温度
| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
(4)石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为

您最近一年使用:0次
6 . 中科院宁波研究所的“固态锂电池”即将量产,其技术世界领先。请完成下列问题:
(1)基态锂原子的电子排布式:______ ;基态锂原子中有_____ 种运动状态不同的电子。
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。
①上述反应中涉及的元素的原子半径最大的是______ (填元素名称)。
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:_______ 。
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:_______ 。
(3)Mg与 Al的电离能如下(kJ·mol-1):
第一电离能 Mg大于 Al,但第二电离能 Mg小于 Al,解释原因:_________ 。
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为__________ 。
(1)基态锂原子的电子排布式:
(2)LiAlH4是重要的还原剂与储氢材料。其合成方法如下:① Na+Al+2H2
 NaAlH4,②NaAlH4+LiCl
NaAlH4,②NaAlH4+LiCl LiAlH4+NaCl。
LiAlH4+NaCl。①上述反应中涉及的元素的原子半径最大的是
②LiAlH4与水剧烈反应产生一种盐与 H2,写出反应的化学方程式:
③LiAlH4中 H元素表现为-1价,Li元素为+1价,解释H表现出负价的理由:
(3)Mg与 Al的电离能如下(kJ·mol-1):
| Mg | 737.7 | 1450.7 | … |
| Al | 577.5 | 1816.7 | … |
(4)上述物质的元素中电负性最大的元素与电负性最小的元素形成的化合物的电子式为
您最近一年使用:0次
2020-08-21更新
|
165次组卷
|
3卷引用:吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题
吉林省松原市扶余市第一中学2019-2020学年高二下学期期中考试化学试题山西省运城市2019-2020学年高二下学期期末测试化学试题(已下线)第01章 原子结构与元素性质(A卷基础强化篇)-2020-2021学年高二化学选择性必修2同步单元AB卷(新教材鲁科版)



