名校
解题方法
1 . 我国科学家研发的新型光学材料(Sn7Br10S2)可替代传统光学材料硫镓银(AgGaS2)和磷锗锌(ZnGeP2)。请回答下列问题:
(1)基态硫原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为___________ 。
(2)SF6可用作高压发电系统的绝缘气体,其分子呈正八面体结构,如图所示。
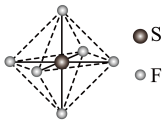
①SF6是___________ (填“极性”或“非极性”)分子。
②1molSF6分子中含___________ molσ键。
(3)HF、HCl、HBr的酸性由强到弱的顺序为___________ (填化学式,下同);沸点由高到低的顺序为___________ ;还原性由强到弱的顺序为___________ 。
(4)Ga(CH3)3和NH3在一定条件下可合成半导体材料GaN和CH4。Ga(CH3)3分子中Ga原子和C原子构成的空间构型是___________ ,碳原子的杂化类型是___________ 。
(5)四卤化锡的熔点如下表所示:
它们熔点递变的主要原因是___________ 。
(1)基态硫原子核外电子云轮廓图呈哑铃形的能级上占据的电子总数为
(2)SF6可用作高压发电系统的绝缘气体,其分子呈正八面体结构,如图所示。

①SF6是
②1molSF6分子中含
(3)HF、HCl、HBr的酸性由强到弱的顺序为
(4)Ga(CH3)3和NH3在一定条件下可合成半导体材料GaN和CH4。Ga(CH3)3分子中Ga原子和C原子构成的空间构型是
(5)四卤化锡的熔点如下表所示:
| 物质 | SnCl4 | SnBr4 | SnI4 |
| 熔点/℃ | ﹣33 | 31 | 144.5 |
您最近一年使用:0次
2 . 磷酸亚铁锂( )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:
(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为________ 形。
(2)Fe元素位于周期表_____ 周期_____ 族;原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为___________ 。
(3)基态Mn2+的价电子排布式为___________ ,锰的第三电离能高于铁的第三电离能,其原因是___________ 。
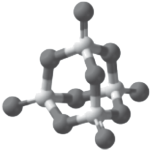
(4)P4S10的分子结构如图所示,其中含有________ 个六元环;______ g P4S10含有8molσ键。
 )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为
(2)Fe元素位于周期表
 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为(3)基态Mn2+的价电子排布式为
(4)P4S10的分子结构如图所示,其中含有
您最近一年使用:0次
2023-12-26更新
|
155次组卷
|
4卷引用:河南省商丘市二十校2023-2024学年高二下学期期中联考化学试卷
3 . 过波金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)基态Cu原子核外K、L层电子的电子云有_____ 种不同的伸展方向。
(2)锌化铜是一种金属互化物,元素铜的第二电离能_____ (填“大于”、“小于”或“等于”)锌的第二电离能,理由是______ 。
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为(CH3)2SO。(CH3)2SO中C-S-O的键角______ (填“大于”、“小于”或“等于”)CH3COCH3中C-C-O的键角,理由是_____ ;元素S、Cl、O的电负性由大到小的顺序为______ 。
(4)利用CuSO4和NaOH制备的Cu(OH)2悬浊液检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);C为( ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为______ 。

②若Cu2O晶体密度为dg•cm-3,晶胞参数为apm,则阿伏加德罗常数值NA为______ (用含d和a的式子表示)。
(1)基态Cu原子核外K、L层电子的电子云有
(2)锌化铜是一种金属互化物,元素铜的第二电离能
(3)[Co(DMSO)6](ClO4)2是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为(CH3)2SO。(CH3)2SO中C-S-O的键角
(4)利用CuSO4和NaOH制备的Cu(OH)2悬浊液检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);C为(
 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为
②若Cu2O晶体密度为dg•cm-3,晶胞参数为apm,则阿伏加德罗常数值NA为
您最近一年使用:0次
4 . 2020年12月17日嫦娥五号返回器携带月球土壤样品在预定区域安全着陆,研究人员在样品中发现了辉钼矿( )。请回答下列问题:
)。请回答下列问题:
(1)区别 是否为晶体的常用科学方法为
是否为晶体的常用科学方法为____ 。
(2)已知钼在元素周期表中呈现的信息如下:
①基态钼原子核外电子占据最高能层的符号是___ 。
②钼在元素周期表中位于第五周期___ 族,第四周期元素中与钼位于同一族的元素是___ (填元素符号);原子序数为47的元素的基态原子的核外电子排布式为
____ 。
③价电子排布处于下列状态的钼原子或离子失去一个电子所需能量最高的是___ (填序号)。
A. B.
B. C.
C. D.
D.
(3) 纳米粒子具有类似于石墨的层状结构,被誉为“固体消滑剂之王”,具有优异的润滑性能,其原因是
纳米粒子具有类似于石墨的层状结构,被誉为“固体消滑剂之王”,具有优异的润滑性能,其原因是__ 。
(4)组铝合金( )性能优良,其晶胞结构如图1所示(
)性能优良,其晶胞结构如图1所示( 原子未画出),其中
原子未画出),其中 原子按体心立方密堆积,每个
原子按体心立方密堆积,每个 原子周围围绕的
原子周围围绕的 原子形成正二十面体(如图2),即每个
原子形成正二十面体(如图2),即每个 原子位于正二十面体的中心。已知该晶胞的体积为
原子位于正二十面体的中心。已知该晶胞的体积为 ,则该晶体的密度为
,则该晶体的密度为__  (设
(设 为阿伏加德罗常数的值,用含V、
为阿伏加德罗常数的值,用含V、 的代数式表示)。
的代数式表示)。

 )。请回答下列问题:
)。请回答下列问题:(1)区别
 是否为晶体的常用科学方法为
是否为晶体的常用科学方法为(2)已知钼在元素周期表中呈现的信息如下:

①基态钼原子核外电子占据最高能层的符号是
②钼在元素周期表中位于第五周期

③价电子排布处于下列状态的钼原子或离子失去一个电子所需能量最高的是
A.
 B.
B. C.
C. D.
D.
(3)
 纳米粒子具有类似于石墨的层状结构,被誉为“固体消滑剂之王”,具有优异的润滑性能,其原因是
纳米粒子具有类似于石墨的层状结构,被誉为“固体消滑剂之王”,具有优异的润滑性能,其原因是(4)组铝合金(
 )性能优良,其晶胞结构如图1所示(
)性能优良,其晶胞结构如图1所示( 原子未画出),其中
原子未画出),其中 原子按体心立方密堆积,每个
原子按体心立方密堆积,每个 原子周围围绕的
原子周围围绕的 原子形成正二十面体(如图2),即每个
原子形成正二十面体(如图2),即每个 原子位于正二十面体的中心。已知该晶胞的体积为
原子位于正二十面体的中心。已知该晶胞的体积为 ,则该晶体的密度为
,则该晶体的密度为 (设
(设 为阿伏加德罗常数的值,用含V、
为阿伏加德罗常数的值,用含V、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
5 . 钛及其化合物在工业、医疗、航天等多方面都有广泛的应用,越来越受到人们的关注。
(1)钛在周期表中的位置___________ , 钛原子核外有___________ 种空间运动状态不同的电子, Ti2+电子占据的最高能层的电子排布式为___________ 。
(2)已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是___________ 。
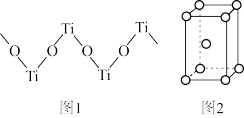
(3)硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为___________ , 该晶体中阴离子的空间构型为___________ 。
(4)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为___________ ,,B原子的杂化方式是___________ ,其中的BH 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有___________ (填序号)
①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(5)单质钛晶体的晶胞结构如图2所示,则钛的这种堆积方式称为___________ , 若钛原子半径为r pm,NA表示阿伏加德罗常数的值,金属钛的密度为___________ g/cm3(列出计算式即可)
(1)钛在周期表中的位置
(2)已知钛和铝的相对原子半径分别是1. 45和1.43 ,钛的硬度比铝大的原因是
(3)硫酸氧钛晶体中的阳离子为链状聚合形式的离子,结构如图1所示,该阳离子的化学符号为

(4)Ti(BH4)2是一种储氢材料,其中所含元素的电负性由小到大排列顺序为
 可由BH3和H-结合而成。BH
可由BH3和H-结合而成。BH 含有
含有①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(5)单质钛晶体的晶胞结构如图2所示,则钛的这种堆积方式称为
您最近一年使用:0次
6 . B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域都有广泛的应用。
(1)在基态Ti原子中,核外存在________ 对自旋相反的电子,核外电子中占据的最高能层符号为___ ,占据该能层电子的电子云轮廓图形状为_________ 。
(2)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法不正确的是_________ 。
A. (N5)6(H3O)3(NH4)4Cl中含四种离子 B. N5+N5-属于共价化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(3)NH3分子空间结构为_______ ;在 BF3中B原子的杂化方式为______ 。
(4)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-离子,则钛元素的化合价是______ ,配体是_____ 。
(5)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
请解释碱土金属元素碳酸盐热分解温度的变化规律:____________ 。
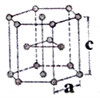
(6)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a = 0.295nm,c=0.469nm,则该钛晶体的密度为______ g/cm3(用NA表示阿伏伽德罗常数的值,列出计算式即可)。
(1)在基态Ti原子中,核外存在
(2)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法不正确的是
A. (N5)6(H3O)3(NH4)4Cl中含四种离子 B. N5+N5-属于共价化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(3)NH3分子空间结构为
(4)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-离子,则钛元素的化合价是
(5)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/ pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:
(6)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a = 0.295nm,c=0.469nm,则该钛晶体的密度为

您最近一年使用:0次
解题方法
7 . (1)以下对核外电子运动状态的描述正确的是_____ (填标号)
A.能层序数越大,s电子云的半径越大
B.在同一能级上运动的电子,其运动状态肯定相同
C.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
D.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
(2)下面是一些原子的2p能级和3d 能级中电子排布的情况,其中正确的是____ (填标号)
A.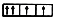 B.
B. C.
C.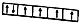 D.
D.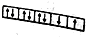
(3)下列说法正确的是_____ (填标号)
A.所有物质中都存在化学键
B. σ键和π键都只能存在于共价分子中
C.全部由非金属元素组成的化合物中肯定不存在离子键
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
A.能层序数越大,s电子云的半径越大
B.在同一能级上运动的电子,其运动状态肯定相同
C.电子的运动与行星相似,围绕原子核在固定的轨道上高速旋转
D.能量低的电子只能在s轨道上运动,能量高的电子总是在f轨道上运动
(2)下面是一些原子的2p能级和3d 能级中电子排布的情况,其中正确的是
A.
 B.
B. C.
C. D.
D.
(3)下列说法正确的是
A.所有物质中都存在化学键
B. σ键和π键都只能存在于共价分子中
C.全部由非金属元素组成的化合物中肯定不存在离子键
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
您最近一年使用:0次
2018-02-21更新
|
171次组卷
|
2卷引用:河南省豫南九校2017-2018学年高二上学期期末联考化学试题1



