1 . 近年来,我国航空航天事业成果显著,航空航天材料技术快速发展。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。基态钛原子的价层电子排布图为___________ 。
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,基态镓原子电子占据最高能级的电子云轮廓图为____________ 形。
(3)“C919”飞机机身使用复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的能量最低状态的是___________ (填字母)。
A.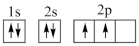 B.
B. 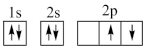 C.
C.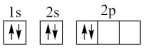 D.
D.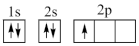
②氧原子的基态原子核外有___________ 个未成对电子。
(1)“天宫二号”航天器使用了钛合金,质量轻,强度位于金属之首。基态钛原子的价层电子排布图为
(2)“北斗三号”导航卫星使用的太阳能电池材料砷化镓是优良的化合物半导体,基态镓原子电子占据最高能级的电子云轮廓图为
(3)“C919”飞机机身使用复合材料——碳纤维和环氧树脂。
①下列电子排布图能表示碳原子的能量最低状态的是
A.
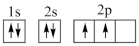 B.
B.  C.
C.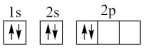 D.
D.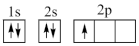
②氧原子的基态原子核外有
您最近一年使用:0次
名校
2 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有____ 种不同能量的电子,具有_____ 种不同空间运动状态的电子,具有____ 种不同运动状态的电子。
(3)基态Cr原子的简化电子排布式为_________ ,基态Se原子的价电子轨道表示式为______ 。
(4)元素Cu在元素周期表中的位置_____ ,属于_____ 区,化合物 在加热条件下容易转化为
在加热条件下容易转化为 ,从原子结构的角度解释原因
,从原子结构的角度解释原因___________ 。
(5) 是离子晶体,其形成过程中的能量变化如图所示。
是离子晶体,其形成过程中的能量变化如图所示。
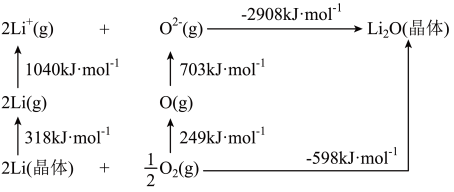
可知,Li原子的第一电离能为____  ,
, 键键能为
键键能为_____  。
。
(1)下列有关说法错误的是___________。
A.简单离子的还原性: |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(2)基态V原子中具有
(3)基态Cr原子的简化电子排布式为
(4)元素Cu在元素周期表中的位置
 在加热条件下容易转化为
在加热条件下容易转化为 ,从原子结构的角度解释原因
,从原子结构的角度解释原因(5)
 是离子晶体,其形成过程中的能量变化如图所示。
是离子晶体,其形成过程中的能量变化如图所示。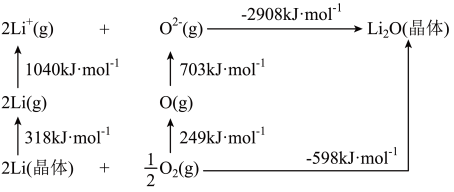
可知,Li原子的第一电离能为
 ,
, 键键能为
键键能为 。
。
您最近一年使用:0次
3 . 磷酸亚铁锂( )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:
(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为________ 形。
(2)Fe元素位于周期表_____ 周期_____ 族;原子核外电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为___________ 。
(3)基态Mn2+的价电子排布式为___________ ,锰的第三电离能高于铁的第三电离能,其原因是___________ 。
(4)P4S10的分子结构如图所示,其中含有________ 个六元环;______ g P4S10含有8molσ键。
 )和锰酸锂(
)和锰酸锂( )均可用作锂离子电池正极材料。回答下列问题:
)均可用作锂离子电池正极材料。回答下列问题:(1)基态Li原子核外电子所占据最高能级的电子云轮廓图为
(2)Fe元素位于周期表
 和
和 表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为
表示,称为电子的白旋磁量子数,基态Fe原子的价电子自旋磁量子数的代数和为(3)基态Mn2+的价电子排布式为
(4)P4S10的分子结构如图所示,其中含有
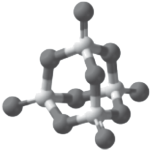
您最近一年使用:0次
2023-12-26更新
|
141次组卷
|
2卷引用:青海省海南州高级中学、共和县高级中学2023-2024学年高二上学期期中联考化学试题
解题方法
4 . 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子中,占据最高能级电子的电子云轮廓图形状为___________ 。
(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是___________ 。
(ii)离子半径:Li+___________ H-(填“>”“=”或“<”)。
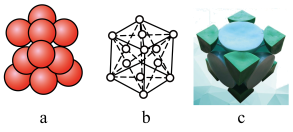
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:
(i)晶胞中锂的配位数为___________ 。
(ii)若锂原子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为___________  (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是
(ii)离子半径:Li+
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:

(i)晶胞中锂的配位数为
(ii)若锂原子的半径为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为 (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2023-10-28更新
|
93次组卷
|
2卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
5 . 许多物质中同一元素可以存在多种化合价, 或是可以看成存在多种化合价,这样有助于把握某些反应的本质。元素R是最高化合价为+6的短周期元素,Na2R2O8是一种极强的氧化剂,该物质的某种元素可以看成存在多种化合价。注:回答下列问题时,必须用R元素的真实元素符号作答。
(1)R元素的基态原子中,具有_______ 种不同空间运动状态的电子,具有_______ 种不同运动状态的电子。
(2)已知氧化性: >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到_______ 的现象。该过程中被还原的元素是_______ 。
(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式_______ 。
(1)R元素的基态原子中,具有
(2)已知氧化性:
 >
> >I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到
>I2。若将Na2R2O8溶液逐滴滴加到淀粉KI试纸上,则可以看到(3)加热Na2R2O8溶液,可以放出一种无色无味气体,结合上述信息,写出该反应的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 据《科学》报道,中国科学家首次实现超导体(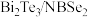 )中分段费米面。回答下列问题:
)中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为_______ 。基态Se原子核外电子云轮廓图呈哑铃形的能级上共有_______ 个电子
(2)二氯二茂铌的组成为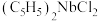 环戊二烯阴离子(
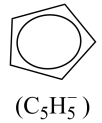
环戊二烯阴离子(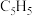 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①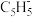 中C原子的杂化类型是
中C原子的杂化类型是_______ 。
②已知分子中的大π键可以用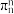 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则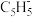 中大π键可以表示为
中大π键可以表示为_______ 。
(3) 的空间构型为
的空间构型为_______ 。
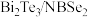 )中分段费米面。回答下列问题:
)中分段费米面。回答下列问题:(1)Bi与P位于同主族,基态P原子的价层电子排布式为
(2)二氯二茂铌的组成为
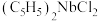 环戊二烯阴离子(
环戊二烯阴离子(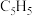 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①
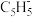 中C原子的杂化类型是
中C原子的杂化类型是②已知分子中的大π键可以用
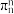 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则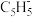 中大π键可以表示为
中大π键可以表示为(3)
 的空间构型为
的空间构型为
您最近一年使用:0次
2022-04-22更新
|
160次组卷
|
2卷引用:安徽省安庆市第二中学2021-2022学年高二下学期期中考试化学试题
解题方法
7 . 元素A、B、C、D都是短周期元素,A元素原子的2p轨道上仅有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是同周期中电负性最大的,D的气态氢化物的水溶液能使无色酚酞试液变红。试回答:
(1)A的最外层电子轨道排布图为___ ;B的电子排布式为___ ;C的最外层电子排布式为__ ;D的原子结构示意图为___ 。
(2)D与H原子形成的某气态化合物溶于水能使酚酞溶液变红,请解释原因:__ 。已知D与H原子能形成一种高能量的分子D2H2,其中D原子满足8电子结构特征,则该分子的电子式为___ 。
(3)B的原子核外电子运动状态有__ 种,原子轨道数为__ ,有__ 种能量不同的电子,电子占据的最高能量的电子层符号为__ 。
(4)四种元素最高价氧化物水化物酸性由强到弱的是(用对应化学式回答)__ 。
(1)A的最外层电子轨道排布图为
(2)D与H原子形成的某气态化合物溶于水能使酚酞溶液变红,请解释原因:
(3)B的原子核外电子运动状态有
(4)四种元素最高价氧化物水化物酸性由强到弱的是(用对应化学式回答)
您最近一年使用:0次
名校
8 . 氯化铵被广泛用于医药、干电池、织物印染、洗涤等领域。氯化铵T1温度下有以下平衡:
(1)N原子最外层电子有______ 种运动状态;上述平衡中物质,在晶体时属于离子晶体的是__________ 。
(2) 的电子式为
的电子式为______________ 。
(3)Cl的非金属性强于S,用原子结构的知识说明理由:_________________ 。
(4)上述该反应的平衡常数表达式为____________________________________ 。
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是_________ 。

(6)T1温度在2L,容器中,当平衡时测得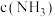 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得 为bmol/L。试比较a与b的大小a
为bmol/L。试比较a与b的大小a_____ b(填“>”“<”或“=”),并说明理由:___________ 。

(1)N原子最外层电子有
(2)
 的电子式为
的电子式为(3)Cl的非金属性强于S,用原子结构的知识说明理由:
(4)上述该反应的平衡常数表达式为
(5)在2L密闭容器中建立平衡,不同温度下氨气浓度变化正确的是

(6)T1温度在2L,容器中,当平衡时测得
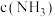 为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得
为amol/L,保持其他条件不变,压缩容器体积至1L(各物质状态不变),重新达到平衡后测得 为bmol/L。试比较a与b的大小a
为bmol/L。试比较a与b的大小a
您最近一年使用:0次
2019-08-22更新
|
284次组卷
|
2卷引用:上海嘉定一中2020届高三上学期期中考试化学试题
名校
解题方法
9 . 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Ga 基态原子核外电子排布式为_______ ,As 基态原子核外有_______ 个未成对电子。
(2)Ga、As、Se 的电负性由大到小的顺序是__________ 。
(3)GaCl3和AsF3的立体构型分别是____________ ,__________ 。
(4)比较下列镓的卤化物的熔点和沸点,分析其变化的原因:____________ 。
GaF3的熔点超过1000 ℃,可能的原因是_____ 。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。[B(OH)4]-中B原子的杂化类型为______ 。
(6)若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅,若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________ (用化学式表示);
(1)Ga 基态原子核外电子排布式为
(2)Ga、As、Se 的电负性由大到小的顺序是
(3)GaCl3和AsF3的立体构型分别是
(4)比较下列镓的卤化物的熔点和沸点,分析其变化的原因:
| 镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000 ℃,可能的原因是
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。[B(OH)4]-中B原子的杂化类型为
(6)若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅,若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
您最近一年使用:0次



