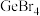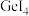名校
解题方法
1 . A、B、C、D、E、F为原子序数依次增大的前四周期元素,A元素原子最外层电子数是其内层电子数的2.5倍,B元素是地壳中含量最高的元素,C元素的最高化合价和最低化合价的代数和等于0,D元素的单质可用于自来水消毒杀菌,E元素位于周期表的VIB族,F元素的基态原子中有4个未成对电子。
(1)A元素单质的结构式为_______ ,基态E元素原子价层电子排布图为_______ 。
(2)A的氢化物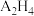 分子属于
分子属于_______ 分子(填“极性或非极性”),A与B形成的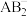 的空间构型为
的空间构型为_______ 。
(3)火箭推动剂由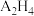 和
和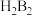 组成,加热反应时有
组成,加热反应时有 元素的单质生成,写出该化学反应方程式:
元素的单质生成,写出该化学反应方程式:_______ 。基态 未成对电子数为
未成对电子数为_______ 个。
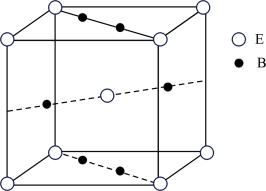
(4)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为apm, 为阿伏加德罗常数的值,则该晶胞的密度为
为阿伏加德罗常数的值,则该晶胞的密度为_______  。
。
(1)A元素单质的结构式为
(2)A的氢化物
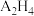 分子属于
分子属于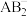 的空间构型为
的空间构型为(3)火箭推动剂由
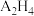 和
和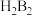 组成,加热反应时有
组成,加热反应时有 元素的单质生成,写出该化学反应方程式:
元素的单质生成,写出该化学反应方程式: 未成对电子数为
未成对电子数为(4)元素B与E形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。若晶胞参数(边长)为apm,
 为阿伏加德罗常数的值,则该晶胞的密度为
为阿伏加德罗常数的值,则该晶胞的密度为 。
。
您最近一年使用:0次
2 . 配合物在许多方面有着广泛的用途,目前我国科学家利用配合物在能源转化与储存方面有着杰出的贡献,请根据题意回答下列问题:(已知: 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色)
在溶液中为黄色)
(1)下列反应曾用于检测司机是否酒后驾驶,原理如下:

基态Cr原子外围电子轨道表示式为___________ ;配合物 中与Cr3+形成配位键的原子是
中与Cr3+形成配位键的原子是___________ (填元素符号)。
(2)现有下列实验:___________ ,溶剂X可以是___________ (填名称),继续添加氨水,沉淀溶解的离子方程式为___________ 。
②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是___________ 。
(3)下列有关化学实验的“操作→现象→解释”均正确的是___________(填字母)。
 在溶液中为橙色,
在溶液中为橙色, 在溶液中为黄色)
在溶液中为黄色)(1)下列反应曾用于检测司机是否酒后驾驶,原理如下:

基态Cr原子外围电子轨道表示式为
 中与Cr3+形成配位键的原子是
中与Cr3+形成配位键的原子是(2)现有下列实验:

②该实验能说明NH3、H2O与Cu2+结合的能力由强到弱的顺序是
(3)下列有关化学实验的“操作→现象→解释”均正确的是___________(填字母)。
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | 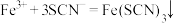 |
| B | 向由0.1mol CrCl3∙6H2O配成的溶液中加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则CrCl3∙6H2O的化学式可表示为 |
| C | 向K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后变为黄色 | 溶液中存在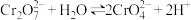 |
| D | 向AgCl悬浊液中滴加氨水 | 沉淀溶解 | AgCl不溶于水,但溶于氨水,重新电离成Ag+和Cl- |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 铁及其化合物在生活、生产中有重要应用。回答下列问题:
(1)乳酸亚铁 是一种常用的补铁剂。
是一种常用的补铁剂。
① 的价电子排布图为
的价电子排布图为___________ 。 可用于治疗急性心率衰竭。
可用于治疗急性心率衰竭。
①硝普钠中 的配位数为
的配位数为___________ 。
②硝普钠中不存在的化学键有___________ (填序号)。
a.离子键 b.金属键 c. 配位键 d.极性共价键
(3)咔唑 (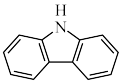 ),)用于制备靶向Fe2+荧光探针,咔唑沸点比
),)用于制备靶向Fe2+荧光探针,咔唑沸点比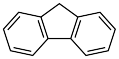 高的主要原因是
高的主要原因是___________ ,咔唑分子中所有原子共平面,咔唑与  都能与
都能与  配位,配位能力: 咔唑
配位,配位能力: 咔唑___________ 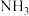 (填"> "、"<"、"=")。
(填"> "、"<"、"=")。
(4)由铁、钾、硒形成的一种超导材料,其晶胞结构和xy平面投影如图所示。___________ 。
②该晶胞参数分别为 a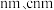 ,该晶体密度
,该晶体密度
___________ 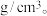 ( 用
( 用  表示阿伏加德罗常数 )
表示阿伏加德罗常数 )
(1)乳酸亚铁
 是一种常用的补铁剂。
是一种常用的补铁剂。①
 的价电子排布图为
的价电子排布图为②乳酸分子( )中
)中  键与
键与  键的数目之比为
键的数目之比为
 可用于治疗急性心率衰竭。
可用于治疗急性心率衰竭。①硝普钠中
 的配位数为
的配位数为②硝普钠中不存在的化学键有
a.离子键 b.金属键 c. 配位键 d.极性共价键
(3)咔唑 (
 ),)用于制备靶向Fe2+荧光探针,咔唑沸点比
),)用于制备靶向Fe2+荧光探针,咔唑沸点比 高的主要原因是
高的主要原因是 都能与
都能与  配位,配位能力: 咔唑
配位,配位能力: 咔唑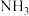 (填"> "、"<"、"=")。
(填"> "、"<"、"=")。(4)由铁、钾、硒形成的一种超导材料,其晶胞结构和xy平面投影如图所示。

②该晶胞参数分别为 a
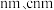 ,该晶体密度
,该晶体密度
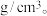 ( 用
( 用  表示阿伏加德罗常数 )
表示阿伏加德罗常数 )
您最近一年使用:0次
名校
解题方法
4 . 以NaOH、 和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下:
和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下: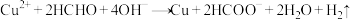
(1)基态Cu原子的价层电子轨道表示式为______
(2)根据反应原理分析
①镀铜反应中,利用了HCHO的______ 性。
②选择HCHO进行化学镀铜的原因之一是它易溶于水。下列分析正确的是______ 。
a.HCHO、 均属于极性分子
均属于极性分子
b.HCHO与 之间能形成氢键
之间能形成氢键
c.在醛基的碳氧双键中,电子偏向碳原子
(3)镀液中的 、HCHO、
、HCHO、 三种微粒,空间结构为平面三角形的是
三种微粒,空间结构为平面三角形的是______ 。
(4)为防止 与
与 形成沉淀,可加入EDTA使
形成沉淀,可加入EDTA使 形成配合物。EDTA能电离出
形成配合物。EDTA能电离出 和
和
 中除部分O外,还能与
中除部分O外,还能与 配位的原子是
配位的原子是______ 。
(5)铜―镍镀层能增强材料的耐蚀性。按照核外电子排布,把元素周期表划分为5个区。Ni位于______ 区。
(6)聚酰亚胺具有高强度、耐紫外线、优良的热氧化稳定性等性质。某聚酰亚胺具有如下结构特征:
①______ 。
②聚酰亚胺在碱性条件下会发生水解。
 和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下:
和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下: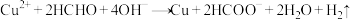
(1)基态Cu原子的价层电子轨道表示式为
(2)根据反应原理分析
①镀铜反应中,利用了HCHO的
②选择HCHO进行化学镀铜的原因之一是它易溶于水。下列分析正确的是
a.HCHO、
 均属于极性分子
均属于极性分子b.HCHO与
 之间能形成氢键
之间能形成氢键c.在醛基的碳氧双键中,电子偏向碳原子
(3)镀液中的
 、HCHO、
、HCHO、 三种微粒,空间结构为平面三角形的是
三种微粒,空间结构为平面三角形的是(4)为防止
 与
与 形成沉淀,可加入EDTA使
形成沉淀,可加入EDTA使 形成配合物。EDTA能电离出
形成配合物。EDTA能电离出 和
和
 (
( )
)
 中除部分O外,还能与
中除部分O外,还能与 配位的原子是
配位的原子是(5)铜―镍镀层能增强材料的耐蚀性。按照核外电子排布,把元素周期表划分为5个区。Ni位于
(6)聚酰亚胺具有高强度、耐紫外线、优良的热氧化稳定性等性质。某聚酰亚胺具有如下结构特征:
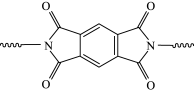
①
②聚酰亚胺在碱性条件下会发生水解。
您最近一年使用:0次
名校
5 . 铋酸钠( )是一种可测定锰的强氧化剂。由辉铋矿(主要成分为
)是一种可测定锰的强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、CuO等杂质)制备
、CuO等杂质)制备 的工艺流程如下:
的工艺流程如下: 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。
②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的pH如表:
回答下列问题:
(1)基态 的3d电子轨道表示式为
的3d电子轨道表示式为_____ ,“滤渣1”的主要成分为_____ (填化学式)。
(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是_______ , 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)已知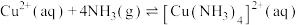 ,
, 中
中 的配位数为
的配位数为_______ ,配体的空间结构为_______ 。
(4)“氧化”过程发生反应的离子方程式为_______ 。
(5)计算常温下 的溶度积常数
的溶度积常数
_______ 。(当溶液中离子浓度 时可认为沉淀完成)
时可认为沉淀完成)
 )是一种可测定锰的强氧化剂。由辉铋矿(主要成分为
)是一种可测定锰的强氧化剂。由辉铋矿(主要成分为 ,含
,含 、
、 、CuO等杂质)制备
、CuO等杂质)制备 的工艺流程如下:
的工艺流程如下:
 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的pH如表:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 7.6 | 2.7 | 4.8 | 4.5 |
| 沉淀完全的pH | 9.6 | 3.7 | 6.4 | 5.5 |
(1)基态
 的3d电子轨道表示式为
的3d电子轨道表示式为(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是
 发生反应的化学方程式为
发生反应的化学方程式为(3)已知
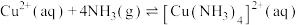 ,
, 中
中 的配位数为
的配位数为(4)“氧化”过程发生反应的离子方程式为
(5)计算常温下
 的溶度积常数
的溶度积常数
 时可认为沉淀完成)
时可认为沉淀完成)
您最近一年使用:0次
名校
6 . 钛(Ti)、铬(Cr)、锰(Mn)、钴(Co)、镉(Cd)等过渡金属及其化合物在生产生活中应用广泛,回答下列问题。
(1)基态Cr原子的价层电子轨道表示式为___________ 。
(2)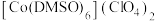 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中Cl原子的杂化轨道类型是
中Cl原子的杂化轨道类型是___________ , 中键角<C-S-O
中键角<C-S-O___________  中键角<C-C-O(填“大于”“小于”或“等于”)。
中键角<C-C-O(填“大于”“小于”或“等于”)。
(3) 与
与 等配体可形成配离子。
等配体可形成配离子。 中2个
中2个 被2个
被2个 替代只得到1种结构,则
替代只得到1种结构,则 的空间构型是
的空间构型是___________ 。
(4)钛与卤素形成的化合物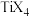 熔点如下表:
熔点如下表:
它们熔点差异的原因___________ 。
(5)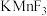 晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在
晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在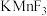 晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为
晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为___________ (填阿拉伯数字序号)。 占据
占据 形成的
形成的___________ (填“四面体空隙”或“八面体空隙”)。 为阿伏加德罗常数的值,钴蓝晶体的密度为
为阿伏加德罗常数的值,钴蓝晶体的密度为___________  (列计算式)。
(列计算式)。
(1)基态Cr原子的价层电子轨道表示式为
(2)
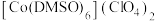 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中Cl原子的杂化轨道类型是
中Cl原子的杂化轨道类型是 中键角<C-S-O
中键角<C-S-O 中键角<C-C-O(填“大于”“小于”或“等于”)。
中键角<C-C-O(填“大于”“小于”或“等于”)。(3)
 与
与 等配体可形成配离子。
等配体可形成配离子。 中2个
中2个 被2个
被2个 替代只得到1种结构,则
替代只得到1种结构,则 的空间构型是
的空间构型是(4)钛与卤素形成的化合物
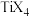 熔点如下表:
熔点如下表: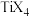 |  |  |  |  |
| 熔点℃ | 377 |  | 38.3 | 153 |
(5)
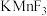 晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在
晶体有钙钛矿型的立方结构,晶胞结构如图1所示。在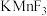 晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为
晶胞结构的另一种表示中,Mn处于各顶角位置,在该晶胞结构中,沿晶胞对角面取得的截图如图2所示。F在晶胞中的位置对应的序号为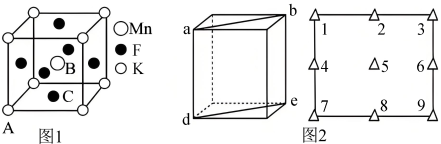
 占据
占据 形成的
形成的 为阿伏加德罗常数的值,钴蓝晶体的密度为
为阿伏加德罗常数的值,钴蓝晶体的密度为 (列计算式)。
(列计算式)。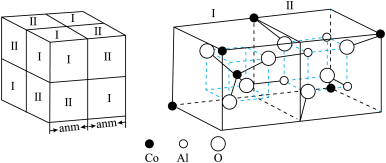
您最近一年使用:0次
名校
7 . 电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是______ 。
(2)四氯化硅属于______ 晶体,硅原子的杂化方式是______ 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是______ 。
(4)比较键角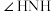 :
: 中的
中的
______  中的
中的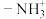 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由______ 。
(1)基态镓原子的价层电子排布图是
(2)四氯化硅属于
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是
|
|
| |
熔点 | -49.5 | 26 | 146 |
沸点 | 83.1 | 186 | 约400 |
 :
: 中的
中的
 中的
中的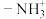 (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由
您最近一年使用:0次
解题方法
8 . 将钴酞菁和三氯化铝复合嵌接在碳纳米管上,可制得一种高效催化剂。
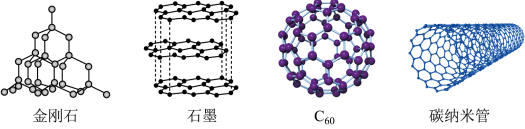
(1)碳的几种单质如图所示。___________ 。
②下列说法正确的是_____ 。
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
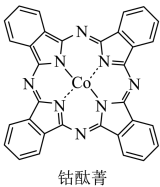
(2)钴酞菁是配位化合物,其分子结构如图所示。____________ 。
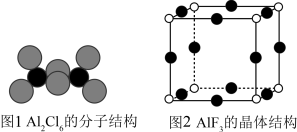
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。________ 。
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是_____________ 。
③AlF3晶体距离F最近的阳离子有_____ 个。
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为_____________ g•cm﹣3。(列出计算式,阿伏加德罗常数用NA表示,1nm=10﹣7cm)
(1)碳的几种单质如图所示。
②下列说法正确的是
a.金刚石中碳碳原子间是σ键
b.C60熔化时破坏的作用力是共价键
c.以上四种单质均能导电
(2)钴酞菁是配位化合物,其分子结构如图所示。
(3)气态AlCl3通常以二聚体Al2Cl6的形式存在,其空间结构如图1所示。AlF3结构属立方晶系,晶胞如图2所示。
②AlCl3的熔点为192℃,远低于AlF3的熔点1090℃的原因是
③AlF3晶体距离F最近的阳离子有
④AlF3的晶胞形状为正方体,边长为anm,该晶体密度为
您最近一年使用:0次
名校
解题方法
9 . 硅烷广泛应用在现代高科技领域。
制备硅烷的反应为 。
。
(1)①基态硅原子的价层电子轨道表示式为___________ 。
② 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是___________ 。
③下列说法正确的是___________ (填字母)。
a. 的稳定性比
的稳定性比 的差
的差
b. 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c. 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的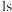 轨道重叠,形成4个
轨道重叠,形成4个 键
键
④ 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是___________ 。
(2) 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为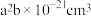 。
。 的
的 模型名称为
模型名称为___________ 。
②用 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为___________  (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
制备硅烷的反应为
 。
。(1)①基态硅原子的价层电子轨道表示式为
②
 中,硅的化合价为+4价。硅显正化合价的原因是
中,硅的化合价为+4价。硅显正化合价的原因是③下列说法正确的是
a.
 的稳定性比
的稳定性比 的差
的差b.
 中4个
中4个 的键长相同,
的键长相同, 的键角为
的键角为
c.
 中硅原子以4个
中硅原子以4个 杂化轨道分别与4个氢原子的
杂化轨道分别与4个氢原子的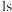 轨道重叠,形成4个
轨道重叠,形成4个 键
键④
 的沸点(-86℃)高于
的沸点(-86℃)高于 的沸点(-112℃),原因是
的沸点(-112℃),原因是(2)
 的晶胞结构如图所示,晶胞的体积为
的晶胞结构如图所示,晶胞的体积为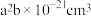 。
。
 的
的 模型名称为
模型名称为②用
 表示阿伏伽德罗常数的值。
表示阿伏伽德罗常数的值。 晶体密度为
晶体密度为 (用含
(用含 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
10 . 钛(22Ti)和钛的合金大量用于航空工业,有“空间金属”之称,制备钛的一种流程如下。___________ 。
(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。___________
②化合物乙中采取sp3杂化原子的第一电离能由大到小的顺序为___________
(3)钙钛矿晶体的结构与晶胞如下图。___________ 个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被___________ 个氧离子包围。
②实验测得钛酸钙的密度为 ,阿伏加德罗常数的值为NA,则钛酸钙晶胞的棱长为
,阿伏加德罗常数的值为NA,则钛酸钙晶胞的棱长为___________ pm(1cm=1×1010pm)。

(2)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图。

②化合物乙中采取sp3杂化原子的第一电离能由大到小的顺序为
(3)钙钛矿晶体的结构与晶胞如下图。

②实验测得钛酸钙的密度为
 ,阿伏加德罗常数的值为NA,则钛酸钙晶胞的棱长为
,阿伏加德罗常数的值为NA,则钛酸钙晶胞的棱长为
您最近一年使用:0次