1 . Ti、Na、Mg、C、N、O、Fe等元素的研究一直在进行中,其单质及化合物在诸多领域都有广泛的应用。回答下列问题:
(1)钠在火焰上灼烧的黄光是一种___________ (填字母)。
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是___________ (填序号)。
a. b.
b.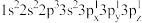
c.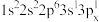 d.
d.
(3)Ti原子位于元素周期表中的_________ 区,最高能层电子的电子云轮廓形状为_________ ,其价电子排布式为___________ 。与Ti同周期的过渡元素中,未成对电子数最多的的基态原子的外围电子的轨道表示式___________ 。
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+___________ Fe2+(填“大于”或“小于”)。
(5)下列各组多电子原子的能级能量比较不正确的是___________。
①2p=3p ②4s>2s ③4p>4f ④4d>3d
(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)下列Mg原子的核外电子排布式中,能量最高的是
a.
 b.
b.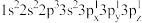
c.
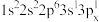 d.
d.
(3)Ti原子位于元素周期表中的
(4)Fe3+与Fe2+的离子半径大小关系为Fe3+
(5)下列各组多电子原子的能级能量比较不正确的是___________。
①2p=3p ②4s>2s ③4p>4f ④4d>3d
| A.①④ | B.①③ | C.③④ | D.②③ |
您最近一年使用:0次
2024-02-16更新
|
211次组卷
|
3卷引用:陕西省宝鸡中学2023-2024学年高二下学期阶段考试(一)化学试题
解题方法
2 . 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第4周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)B基态原子中能量最高的电子,其电子云在空间有___________ 个伸展方向,原子轨道呈___________ 形。
(2)某同学根据上述信息,推断C基态原子的轨道表示式为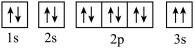 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了___________ 。
(3)G位于___________ 族___________ 区,价电子排布为___________ 。
(4)检验F元素的方法是___________ ,请用原子结构的知识解释产生此现象的原因:________________ 。
(5)写出E的单质与水反应的离子方程式:___________ 。
| 元素 | 相关信息 |
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 原子的第一至第四电离能分别是I1=738 kJ·mol-1;I2=1 451 kJ·mol-1;I3=7 733 kJ·mol-1;I4=10 540 kJ·mol-1 |
| D | 原子核外所有p轨道全充满或半充满 |
| E | 元素的主族序数与周期数的差为4 |
| F | 是前四周期中电负性最小的元素 |
| G | 在周期表的第七列 |
(1)B基态原子中能量最高的电子,其电子云在空间有
(2)某同学根据上述信息,推断C基态原子的轨道表示式为
 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(3)G位于
(4)检验F元素的方法是
(5)写出E的单质与水反应的离子方程式:
您最近一年使用:0次
解题方法
3 . 咔咯(corrole)及其配合物作为人工合成的大环配体之一,咔咯的合成及其与金属离子的配位化学备受关注。利用咔咯作为反应配体,可实现过渡金属离子的非常规氧化态,制备功能材料,探索新型催化剂,等等。下图(a)给出三(五氟苯基)咔咯分子(A)的示意图,简写为H3(tpfc)。它与金属离子结合时四个氮原子均参与配位。室温下,空气中,Cr(CO)6和A在甲苯中回流得到深红色晶体B(反应1),B显顺磁性,有效磁矩为1.72μB,其中金属离子的配位几何为四方锥;在惰性气氛保护下,B与三苯基膦(PPh3)和三苯基氧膦(OPPh3)按1:1:1在甲苯中反应得到绿色晶体C(反应2);在氩气保护下,CrCl2和A在吡啶(简写为py)中反应,得到深绿色晶体D(反应3),D中金属离子为八面体配位,配位原子均为氮原子。在一定的条件下,B、C和D之间可以发生转化(下图b),这一过程被认为有可能用于O2的活化或消除。
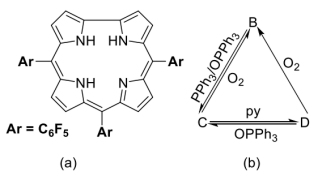
(1)A中的咔咯环是否有芳香性______ ?与之对应的π电子数是______ 。
(2)写出B、C、D的化学式(要求:配体用简写符号表示):
B______ 、C______ 、D______ 。
(3)写出B、C、D中金属离子的价电子组态(均用dn方式表示)。
B______ 、C______ 、D______ 。
(4)写出制备B、C、D的反应方程式(要求:配体用简写符号,系数为最简整数比)。
B______ 、C______ 、D______ 。
(5)利用电化学处理,B可以得电子转化为B-,也可以失去电子转化为B+。与预期的磁性相反,B+依然显示顺磁性。进一步光谱分析发现,与咔咯环配体相关的吸收峰位置发生了显著变化。推测金属离子的价电子组态______ (用dn方式表示),指出磁性与光谱变化的原因______ 。

(1)A中的咔咯环是否有芳香性
(2)写出B、C、D的化学式(要求:配体用简写符号表示):
B
(3)写出B、C、D中金属离子的价电子组态(均用dn方式表示)。
B
(4)写出制备B、C、D的反应方程式(要求:配体用简写符号,系数为最简整数比)。
B
(5)利用电化学处理,B可以得电子转化为B-,也可以失去电子转化为B+。与预期的磁性相反,B+依然显示顺磁性。进一步光谱分析发现,与咔咯环配体相关的吸收峰位置发生了显著变化。推测金属离子的价电子组态
您最近一年使用:0次
名校
解题方法
4 . 据《科技日报》报道,我国科学家研制出一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂,在室温条件下以 为氧化剂可直接将
为氧化剂可直接将 氧化成C的含氧化合物。请回答下列问题:
氧化成C的含氧化合物。请回答下列问题:
(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该基态原子的价层电子排布式为___________ 。
(2)在第四周期过渡金属元素中,基态原子未成对电子数最多的是___________ (填元素符号)。
(3)铜的焰色呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为___________ 。
(4)石墨烯限域单原子铁能活化 分子中的
分子中的 ,导致C与H之间的作用力
,导致C与H之间的作用力___________ (填“增强”或“减弱”)。
(5)常温下,在催化剂作用下, 能氧化
能氧化 生成
生成 、
、 、
、 等。
等。
①它们的沸点由高到低的顺序为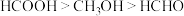 ,主要原因是
,主要原因是___________ 。
② 和
和 相比,键角较大的是
相比,键角较大的是___________ ,主要原因是___________ 。
 为氧化剂可直接将
为氧化剂可直接将 氧化成C的含氧化合物。请回答下列问题:
氧化成C的含氧化合物。请回答下列问题:(1)在Mn、Fe、Co、Ni、Cu中,某基态原子核外电子排布遵循“洪特规则特例”,该基态原子的价层电子排布式为
(2)在第四周期过渡金属元素中,基态原子未成对电子数最多的是
(3)铜的焰色呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为
(4)石墨烯限域单原子铁能活化
 分子中的
分子中的 ,导致C与H之间的作用力
,导致C与H之间的作用力(5)常温下,在催化剂作用下,
 能氧化
能氧化 生成
生成 、
、 、
、 等。
等。①它们的沸点由高到低的顺序为
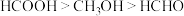 ,主要原因是
,主要原因是②
 和
和 相比,键角较大的是
相比,键角较大的是
您最近一年使用:0次
2021-02-16更新
|
450次组卷
|
4卷引用:(人教版2019)选择性必修2 第二章 分子结构与性质 章末综合检测卷
解题方法
5 . 碱金属及其化合物在生活、科研等领域用途广泛。回答下面相关问题:
(1)基态K原子核外有_______ 种不同的电子运动状态;下列碱金属原子核外电子发生如下变化时有可能会观察到焰色的是_______ (填字母代号)。
a.[Ar]4s1→[Ar]4p1
b.[Ne]3d1→[Ne]3s1
c.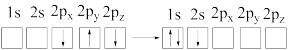
d.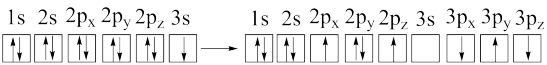
(2)碱金属易形成各种不同的盐,已知碱金属各种盐的沸点(℃)如表所示。
由此可以得出随质子数递增,碱金属形成化合物中化学键的离子性_______ (填“逐渐增强”“不变”或“逐渐减弱”);在硫酸盐和碳酸盐中,S,C原子的杂化形式分别为_______ 和_______ 。
(3)碱金属元素中,仅有Li可以直接与N2化合生成Li3N。已知该晶体中。存在锂、氮原子共同组成的锂、氮层,如图所示。

该结构中,在锂、氮层之间还应存在_______ (填“锂”或“氮”)层。理由是_______ 。
(4)氮化钼是制备锂离子电池的重要原材料,该晶胞结构如图所示。
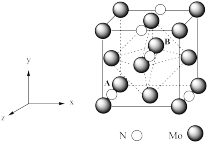
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若A的原子分数坐标为(0,0,0),则B的原子分数坐标为_______ 。
②N原子位于Mo原子立方晶格的_______ (填“四面体”“正方体”或“八面体”)空隙中,若Li位于该晶胞的八面体空隙中,则一个晶胞中最多能够填入_______ 个Li。
③若氮化钼的密度为 g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为
g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为_______ nm。(用含有 ,NA的代数式表示。设NA表示阿伏加德罗常数的值)
,NA的代数式表示。设NA表示阿伏加德罗常数的值)
(1)基态K原子核外有
a.[Ar]4s1→[Ar]4p1
b.[Ne]3d1→[Ne]3s1
c.

d.
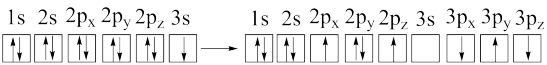
(2)碱金属易形成各种不同的盐,已知碱金属各种盐的沸点(℃)如表所示。
| Li | Na | K | |
| 氧化物 | 613 | 801 | 771 |
| 硫酸盐 | 859 | 880 | 1069 |
| 碳酸盐 | 720 | 858 | 901 |
由此可以得出随质子数递增,碱金属形成化合物中化学键的离子性
(3)碱金属元素中,仅有Li可以直接与N2化合生成Li3N。已知该晶体中。存在锂、氮原子共同组成的锂、氮层,如图所示。

该结构中,在锂、氮层之间还应存在
(4)氮化钼是制备锂离子电池的重要原材料,该晶胞结构如图所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若A的原子分数坐标为(0,0,0),则B的原子分数坐标为
②N原子位于Mo原子立方晶格的
③若氮化钼的密度为
 g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为
g·cm-3,晶胞中Mo为最紧密堆积。其原子半径为r。则Mo所围成的空隙中,所容纳的离子半径最大值为 ,NA的代数式表示。设NA表示阿伏加德罗常数的值)
,NA的代数式表示。设NA表示阿伏加德罗常数的值)
您最近一年使用:0次
2014·山东淄博·二模
6 . 氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是___ 。
a.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是___  向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有
向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有___ 和___ 。
(3)PCl3分子中,Cl-P-Cl键的键角___ 109°28'(填“>”“<”或“2” 。
。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。已知该晶体的密度为ρg·cm-3,晶胞的边长为acm,则阿伏加 德罗常数为___ mol-1(用含p、a的式子表示 。
。

(1)下列关于氮族元素的说法正确的是
a.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是
 向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有
向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有(3)PCl3分子中,Cl-P-Cl键的键角
 。
。(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。已知该晶体的密度为ρg·cm-3,晶胞的边长为acm,则阿伏加 德罗常数为
 。
。
您最近一年使用:0次
2019-12-27更新
|
94次组卷
|
3卷引用:2019年秋高三化学复习强化练习—— 物质结构与性质大题练



