解题方法
1 . 砷(As)可作为半导体材料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________ 性,区分这两种形态的SiO2最可靠的方法足对固体进行___________ 实验。
(2)基态砷原子的价层电子排布图为_____________ ,最高能层符号为_____________ ,Ge、As、Se第一电离能从大到小的顺序为_____________________ 。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________ 。
(4) GeCl4分子中的键角为_____________ ,GeH4分子中Ge的_____________ 轨道和H的_________ 轨道重叠形成σ键。
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________ pm(只列出算式即可),Ga-As键中共用电子对偏向____________ (填“Ga”或“As”)。

(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的
(2)基态砷原子的价层电子排布图为
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因
| 化学键 | C-C | C-H | Ge-Ge | Ge-H |
| 键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为

您最近一年使用:0次
解题方法
2 . 由P、S、Cl、Ni等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)基态Cl原子核外电子排布式为__________________________ ,P、S、Cl的第一电离能由大到小顺序为____________________ 。
(2)SCl2分子中的中心原子杂化轨道类型是_____________ ,该分子构型为__________ 。
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为_______ ;以“—”表示σ键、“→”表示配位键,该分子空间结构示意图可以画为__________ 。
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO_____ NiO(填“>”、“<”或“=”),理由是_______________________________ 。

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为_______ 。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+ 填充其中,已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为______ g。(用a、NA表示)
(1)基态Cl原子核外电子排布式为
(2)SCl2分子中的中心原子杂化轨道类型是
(3)Ni与CO能形成配合物Ni(CO)4,该分子中配位键个数为
(4)已知MgO与NiO的晶体结构(如图1)相同, 其中Mg2+和Ni2+的离子半径分别为66 pm和69pm。则熔点:MgO

(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+ 填充其中,已知O2-的半径为a m,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
2018-03-15更新
|
327次组卷
|
3卷引用:山东省济宁市2018届高三第一次模拟考试理综化学试题
名校
3 . (1)第四周期的某主族元素,其第一至第五电离能数据如下图所示,则该元素对应原子的M层电子排布式为________ 。

(2)如下图所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是____________ 。

(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____ (填序号)。
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因__________ 。
(4)CO2在高温高压下所形成的晶体其晶胞如下图所示。该晶体的熔点比SiO2晶体____ (选填“高”或“低”),该晶体中碳原子轨道的杂化类型为____________ 。

(5)如下图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。

C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;则:C20分子共有____ 个正五边形,共有______ 条棱边。
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为___ (填“有”或“无”)色离子,依据是_______ 。
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为ρ=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为_______ 。

(2)如下图所示,每条折线表示周期表IVA-VIIA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(3)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为
a.离子键 b.配位键 c.氢键 d.非极性共价键
若化合物(CH3)3N能溶于水,试解析其原因
(4)CO2在高温高压下所形成的晶体其晶胞如下图所示。该晶体的熔点比SiO2晶体

(5)如下图为20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。

C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;则:C20分子共有
(6)Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。试推断Ni2+的水合离子为
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(7)晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为ρ=5.71g/cm3,晶胞边长为4.28×10-10m,FexO中x值(精确至0.01)为
您最近一年使用:0次
2018-03-03更新
|
494次组卷
|
3卷引用:山东省济南市2018届高三一模理科综合化学试题
解题方法
4 . 某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________ 。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________ 。
(3)下列说法正确的是___________
a.电负性:As<Ga b.Sic与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。
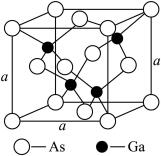
①晶胞中砷与镓原子间的化学键类型有___________ 。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________ 。
③一个晶胞的组成为___________ 。
④已知晶胞棱长a=5.64×10-10m,相对原子质量Ga∶70,As∶75,则该晶胞密度为ρ=___________ 。
(1)砷基态原子的核外电子排布式为
(2)上述非金属元素氢化物的沸点从高到低的顺序为
(3)下列说法正确的是
a.电负性:As<Ga b.Sic与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。

①晶胞中砷与镓原子间的化学键类型有
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是
③一个晶胞的组成为
④已知晶胞棱长a=5.64×10-10m,相对原子质量Ga∶70,As∶75,则该晶胞密度为ρ=
您最近一年使用:0次
解题方法
5 . 由金属Na、Cu、C、N、B等元素组成的物质在生活和工业上有着广泛用途。
(1)基态Cu+的外围电子轨道式为_______ 。
(2)H3BNH3是储氢材料,其制备原理为:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,其中(HB=NH)3是一种六元环状化合物。化合物H3BNH3中B原子的杂化方式为_______ ;1个(HB=NH)3分子中含有 ___ 个σ键。
(3) B、C、N、O原子的第一电离能由大到小的顺序为_____________________ 。
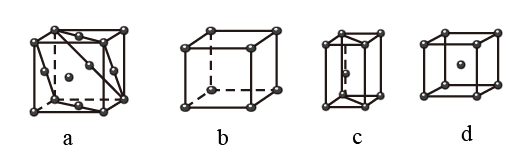
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为____ (填字母)。
(5)已知NaCl的摩尔质量为Mg·mol-1,密度为pg·㎝-3,阿伏伽德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为____________ 。
(1)基态Cu+的外围电子轨道式为
(2)H3BNH3是储氢材料,其制备原理为:3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,其中(HB=NH)3是一种六元环状化合物。化合物H3BNH3中B原子的杂化方式为
(3) B、C、N、O原子的第一电离能由大到小的顺序为
(4)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为

(5)已知NaCl的摩尔质量为Mg·mol-1,密度为pg·㎝-3,阿伏伽德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为
您最近一年使用:0次
6 . 氮是重要的非金属元素,可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子排布式是________________ 。C、N、O三种元素第一电离能从大到小的顺序是____________________ 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是________________________ ;N2H4分子中氮原子轨道的杂化类型是____________________ 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(1)+2N2H4(1)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4molN-H键断裂,则形成的π键有_________ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________ (填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(3)(CH3)3NH+和AlCl4-形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________ (填“大”或“小”),可用作____________ (填代号)。
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
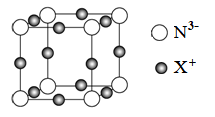
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是___________ ,与同一个N3-相连的X+有_________ 个。
(1)基态氮原子的电子排布式是
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(1)+2N2H4(1)===3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4molN-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
a.离子键 b.共价键 c.配位键 d.范德华力
(3)(CH3)3NH+和AlCl4-形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂
a.助燃剂 b.“绿色”溶剂
c.复合材料 d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是
您最近一年使用:0次
解题方法
7 . 周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。请填写下列空白。
(1)e元素基态原子的核外电子排布式为____________ 。
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为________ (填元素符号),其原因是_________ 。
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为__ ;分子中既含有极性共价键,又含有非极性共价键的化合物是____ (填化学式,写出两种)。
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲________ ,乙_____ ;甲高温易转化为乙的原因是__________________ 。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为__ ,该化合物加热时首先失去的组分是__ ,判断理由是_____ 。

(1)e元素基态原子的核外电子排布式为
(2)b、c、d三种元素的第一电离能数值由小到大的顺序为
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图丙所示)。该化合物中,阴离子为

您最近一年使用:0次
解题方法
8 . A,B,C,D,E,F为前四周期中原子序数依次增大的元素,相关的信息如下:
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种分子式为A2H4的化合物,该分子中存在σ键和π键数目比为_________ ,A的杂化类型为_________ 。
(2)A,B,D,F的氢化物中沸点最高的是_________ (写化学式),A,B,F的第一电离能由大到小的顺序是_________ 。
(3)E位于周期表中的位置是_________ ,E的基态原子的核外电子排布式为_________ 。
(4)根据下列能量变化示意图1,请写出BO和AO2反应的热化学方程式_________

(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为_________ ,将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示,请写出t2时刻总反应的化学方程式_________ 。
(6)下图是E和F形成的化合物的晶胞结构示意图,可确定该化合物的化学式为_________ ,若该晶胞的棱长为apm,则该晶胞的密度为_________ g/cm3。
| 元素 | 相关信息 |
| A | A元素原子核外只有三个能级,且每个能级上含有相等的电子数 |
| B | 是空气中含量最丰富的元素 |
| C | 短周期元素中,C的金属性最强 |
| D | 基态原子第三能层上有7种运动状态不同的电子 |
| E | 一种核素的质量数为63,中子数为34 |
| F | 最外层电子数为次外层的3倍 |
(1)A与氢可形成一种分子式为A2H4的化合物,该分子中存在σ键和π键数目比为
(2)A,B,D,F的氢化物中沸点最高的是
(3)E位于周期表中的位置是
(4)根据下列能量变化示意图1,请写出BO和AO2反应的热化学方程式

(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为
(6)下图是E和F形成的化合物的晶胞结构示意图,可确定该化合物的化学式为

您最近一年使用:0次
名校
解题方法
9 . 钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

回答下列问题:
(1)基态钛原子的价电子排布图为______________ ,其原子核外共有________ 种运动状态不相同的电子。金属钛晶胞如下图1所示,为_______________ 堆积(填堆积方式)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是________ 。
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃,可知TiCl4为________ 晶体。
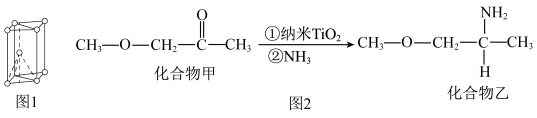
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2。化合物乙的沸点明显高于化合物甲,主要原因是____________ 。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为___________ 。
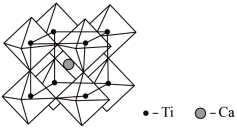
(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被________ 个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被________ 个氧离子包围。钙钛矿晶体的化学式为________________ 。若该晶胞的边长为a pm,则钙钛矿晶体的密度为______ g.cm-3(只要求列算式,不必计算出数值)。

回答下列问题:
(1)基态钛原子的价电子排布图为
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是
| A.180° | B.接近120°,但小于120° |
| C.接近120°,但大于120° | D.接近109°28’,但小于109°28’ |
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2。化合物乙的沸点明显高于化合物甲,主要原因是

(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被

您最近一年使用:0次
2016-12-09更新
|
260次组卷
|
2卷引用:2016届山东省济宁市高三一模理综化学试卷
14-15高三上·江苏·期末
解题方法
10 . 原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1)F原子基态的价电子排布式为_______________ 。
(2)在A、B、C三种元素中,电负性由大到小的顺序是______ >______ >_____ (用元素符号回答)。
(3)元素C的简单气态氢化物的沸点远高于元素E的简单气态氢化物的沸点,其主要原因是________________________ 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的空间构型为_____________ 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为_______________ 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为________________________ 。

(1)F原子基态的价电子排布式为
(2)在A、B、C三种元素中,电负性由大到小的顺序是
(3)元素C的简单气态氢化物的沸点远高于元素E的简单气态氢化物的沸点,其主要原因是
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的空间构型为
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为

您最近一年使用:0次
2016-12-09更新
|
256次组卷
|
7卷引用:2013-2014山东省东营市高三第二次模拟理科综合化学试卷
(已下线)2013-2014山东省东营市高三第二次模拟理科综合化学试卷2016届四川省成都七中等两校高三第二次模拟化学试卷2016-2017学年山东省淄博市淄川中学高二下学期学分认定(期中)考试化学试卷(已下线)2014届江苏省苏北四市高三上期末统考化学试卷2015届江苏省扬州中学高三4月双周测化学试卷2016届四川省乐山市高中高三上学期第二次调研考试化学试卷(已下线)二轮复习 专题17 物质结构与性质 押题专练



