名校
解题方法
1 . 下列关于物质结构和性质的说法正确的是
A.第2周期元素中,第一电离能介于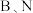 之间的有1种 之间的有1种 |
B.酸性: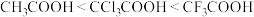 |
C. 与 与 中心原子的杂化方式相同,均为 中心原子的杂化方式相同,均为 形结构 形结构 |
D.乙二胺 的沸点比三甲胺 的沸点比三甲胺 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 高的原因是乙二胺存在分子间氢键,三甲胺存在分子内氢键 |
您最近一年使用:0次
2024-03-21更新
|
607次组卷
|
4卷引用:山东省菏泽市2024届高三一模考试化学试题
山东省菏泽市2024届高三一模考试化学试题(已下线)化学(山东卷02)-2024年高考押题预测卷2024届山东省邹城市北大新世纪高级中学高三下学期第三次模拟考试化学试题山东省滕州市第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
2 . 锡与形成化合物种类最多的元素同主族,是大名鼎鼎的“五金”(金、银、铜、铁、锡)之一,早在我国古代,人们便发现并使用锡。回答下列问题:
(1)Sn位于元素周期表的_______ 区。
(2)某锡的化合物,可作为治疗癌症药物的原料,结构如图(Bu-n为正丁基)。

①结构中一个Sn原子形成的配位键有_______ 个。
②结构中N原子的杂化类型为_______ ,NO 的空间构型为
的空间构型为_______ ,H2O的沸点高于NH3的原因是_______ 。
③结构图中所含有的第二周期元素,其第一电离能由大到小的顺序为_______ (填元素符号)。
(3)某Sn和Nb形成的金属互化物,其晶胞(白球代表Sn,黑球代表Nb)为

晶胞的参数为a(pm),则在体对角线方向的投影为_______ (填字母);若最简的式量为M,阿伏加德罗常数的值为NA,则晶胞的密度为_______ g/cm3。

(1)Sn位于元素周期表的
(2)某锡的化合物,可作为治疗癌症药物的原料,结构如图(Bu-n为正丁基)。

①结构中一个Sn原子形成的配位键有
②结构中N原子的杂化类型为
 的空间构型为
的空间构型为③结构图中所含有的第二周期元素,其第一电离能由大到小的顺序为
(3)某Sn和Nb形成的金属互化物,其晶胞(白球代表Sn,黑球代表Nb)为

晶胞的参数为a(pm),则在体对角线方向的投影为

您最近一年使用:0次
名校
解题方法
3 . 铁、锰、铬、锌、铜及其化合物在生产生活中应用广泛。回答下列问题:
(1)基态Fe原子的价电子排布式为_____ 。
(2)第二电离能: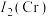
_____  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)一种香豆素衍生物(CHP)可作为测定 的荧光探针,其原理如图所示。
的荧光探针,其原理如图所示。

①CHP所含元素(C、O、N)的电负性从大到小的顺序为_____ (填元素符号,下同);其第一电离能从大到小的顺序为_____ 。
②CHP—Zn中N原子的杂化类型为_____ 。
(4)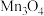 的一种晶体中,氧原子的堆积模型为面心立方最密堆积(如图所示),Mn(Ⅱ)填充在氧原子围成的正四面体空隙中,Mn(Ⅲ)填充在氧原子围成的正八面体空隙中。
的一种晶体中,氧原子的堆积模型为面心立方最密堆积(如图所示),Mn(Ⅱ)填充在氧原子围成的正四面体空隙中,Mn(Ⅲ)填充在氧原子围成的正八面体空隙中。

已知: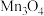 晶胞的体积为
晶胞的体积为 ,
, 表示阿伏加德罗常数,则该晶体的密度为
表示阿伏加德罗常数,则该晶体的密度为_____  (用含
(用含 、V的代数式表示)。
、V的代数式表示)。
(1)基态Fe原子的价电子排布式为
(2)第二电离能:
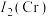
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)一种香豆素衍生物(CHP)可作为测定
 的荧光探针,其原理如图所示。
的荧光探针,其原理如图所示。
①CHP所含元素(C、O、N)的电负性从大到小的顺序为
②CHP—Zn中N原子的杂化类型为
(4)
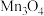 的一种晶体中,氧原子的堆积模型为面心立方最密堆积(如图所示),Mn(Ⅱ)填充在氧原子围成的正四面体空隙中,Mn(Ⅲ)填充在氧原子围成的正八面体空隙中。
的一种晶体中,氧原子的堆积模型为面心立方最密堆积(如图所示),Mn(Ⅱ)填充在氧原子围成的正四面体空隙中,Mn(Ⅲ)填充在氧原子围成的正八面体空隙中。
已知:
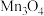 晶胞的体积为
晶胞的体积为 ,
, 表示阿伏加德罗常数,则该晶体的密度为
表示阿伏加德罗常数,则该晶体的密度为 (用含
(用含 、V的代数式表示)。
、V的代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . 短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子的2p轨道上,有1个电子的自旋方向与其他电子的自旋方向相反。Y原子M层上有两个未成对电子,基态W原子的电子总数是其最高能级电子数的4倍。下列说法错误的是
A.第一电离能: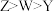 | B.简单离子还原性: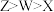 |
C.原子半径: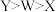 | D.简单氢化物的沸点: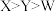 |
您最近一年使用:0次
2023-04-25更新
|
701次组卷
|
3卷引用:山东省菏泽市2023届高三二模化学试题
名校
解题方法
5 . X、Y、Z、M、Q五种短周期主族元素,原子序数依次增大。X的2s轨道全充满,Y的s能级电子数量是p能级的两倍,M原子核外有8种运动状态不同的电子,Q是短周期中除稀有气体元素外原子半径最大的元素。下列说法不正确的是
A.第一电离能: |
| B.Q与M形成的二元化合物中可能含有非极性共价键 |
C.最高正化合价: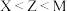 |
D.最高价氧化物对应水化物的酸性: |
您最近一年使用:0次
2023-03-24更新
|
374次组卷
|
8卷引用:2024届山东省菏泽外国语学校高三下学期三模化学试题
6 . 居里夫妇用α粒子( )轰击某金属原子
)轰击某金属原子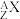 得到
得到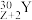 ,基态Y原子3p能级半充满。
,基态Y原子3p能级半充满。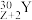 具有放射性,很快衰变为
具有放射性,很快衰变为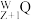 :
: ,
,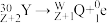 。下列说法正确的是
。下列说法正确的是
 )轰击某金属原子
)轰击某金属原子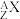 得到
得到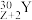 ,基态Y原子3p能级半充满。
,基态Y原子3p能级半充满。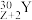 具有放射性,很快衰变为
具有放射性,很快衰变为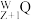 :
: ,
,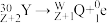 。下列说法正确的是
。下列说法正确的是| A.第一电离能:X<Q<Y |
B.自然界不存在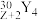 分子是因其化学键不稳定 分子是因其化学键不稳定 |
| C.X原子核内中子数与质子数之比为13:14 |
| D.简单氢化物的热稳定性:Y<Q |
您最近一年使用:0次
2023-02-22更新
|
654次组卷
|
6卷引用:山东省菏泽市2023届高三一模考试化学试题
山东省菏泽市2023届高三一模考试化学试题(已下线)化学-2023年高考押题预测卷02(山东卷)(含考试版、全解全析、参考答案、答题卡)江西省抚州市崇仁一中、广昌一中、金溪县第一中学2022-2023学年高二下学期第一次月考联考化学试题(已下线)专题06 物质结构与性质黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二下学期7月期末考试化学试题山东省泰安市新泰第一中学老校区(新泰中学)2023-2024学年高二下学期第一次月考化学试题
解题方法
7 . 镍铜合金由 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。
(1)基态镍原子的价电子排布式为_______ ,同周期且基态原子的单电子数与 相同的元素有
相同的元素有_______ 种。
(2) 与
与 的第二电离能分别为:
的第二电离能分别为: ,
, ,
, 大于
大于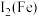 的主要原因是
的主要原因是_______ 。
(3) 可与
可与 甲基咪唑(
甲基咪唑(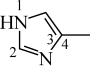 )形成配合物。
)形成配合物。 甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
①4—甲基咪唑中,_______ (填“1”或“3”)号N原子更容易与Cu+形成配位键。
②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是_______ 。
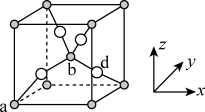
(4)已知 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。
①已知a、b的坐标参数依次为 ,则d的坐标参数为
,则d的坐标参数为_______ ,它代表_______ 原子。
②若铜、氧的原子半径分别为 ,
, 晶体的密度为
晶体的密度为 ,
, 是阿伏加德罗常数的值,则该晶胞中原子空间占有率为
是阿伏加德罗常数的值,则该晶胞中原子空间占有率为_______  (用含
(用含 的式子表示,不必化简)。
的式子表示,不必化简)。
 镍、
镍、 铜、
铜、 铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。
铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。(1)基态镍原子的价电子排布式为
 相同的元素有
相同的元素有(2)
 与
与 的第二电离能分别为:
的第二电离能分别为: ,
, ,
, 大于
大于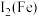 的主要原因是
的主要原因是(3)
 可与
可与 甲基咪唑(
甲基咪唑( )形成配合物。
)形成配合物。 甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。
甲基咪唑中,1号N原子的孤电子对因参与形成大π键,电子云密度降低。①4—甲基咪唑中,
②配位原子提供孤电子对的能力是影响配体与Cu+之间配位键强度的一个重要因素。若用某结构相似的含O配体与Cu+配位,所得配合物的稳定性比含N配体低,可能的原因是
(4)已知
 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。①已知a、b的坐标参数依次为
 ,则d的坐标参数为
,则d的坐标参数为
②若铜、氧的原子半径分别为
 ,
, 晶体的密度为
晶体的密度为 ,
, 是阿伏加德罗常数的值,则该晶胞中原子空间占有率为
是阿伏加德罗常数的值,则该晶胞中原子空间占有率为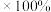 (用含
(用含 的式子表示,不必化简)。
的式子表示,不必化简)。
您最近一年使用:0次
名校
8 . 科学家为了解决电池的导电性问题,合成出了一种高效化合物,其结构如图1所示,其中W、Y、Z、X、Q均为短周期主族元素,其原子半径与原子序数的关系如图2,Z和Q位于同一主族。下列说法错误的是

A.简单离子的半径: | B.第一电离能: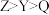 |
C.简单氢化物分子的键角: | D.W、X、Q均可与Z形成两种常见的二元化合物 |
您最近一年使用:0次
2022-05-11更新
|
392次组卷
|
2卷引用:山东省菏泽市2022届高三二模考试化学试题
9 . X、Y为第二周期相邻的两种元素,X的最高正价与最低负价代数和为2,二者形成的固态化合物以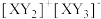 的形式存在,下列说法错误的是
的形式存在,下列说法错误的是
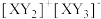 的形式存在,下列说法错误的是
的形式存在,下列说法错误的是| A.原子半径:X>Y |
| B.X、Y均属于p区元素 |
| C.X、Y的第一电离能:X<Y |
| D.X、Y的简单氢化物热稳定性:X<Y |
您最近一年使用:0次
名校
解题方法
10 . 《日华子本草》中已有关于雄黄的记载“雄黄,通赤亮者为上,验之可以虫死者为真。”雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。 回答下列问题:
(1)基态砷原子的价电子轨道排布图为_______ ,核外电子占据的最高能级的电子云轮廓图形状为_______ 。
(2) S、P和N三种元素第一电离能由大到小的顺序是_______ 。
(3) 雄黄(As4S4)的结构如图1所示,S原子的杂化形式为_______ 。
(4) SO2分子中的 键数为
键数为______ 个,分子的空间构型为_______ 。分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则SO2中的大
),则SO2中的大 键应表示为
键应表示为______ 。SO2分子中S—O键的键角_____ NO3-中N—O键的键角(填“> ”、“<”、“=”)。
(5)砷化镓是优良的半导体材料,密度为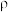 g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏伽德罗常数值为NA,则砷化镓晶体的空间利用率为
g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏伽德罗常数值为NA,则砷化镓晶体的空间利用率为________ 。
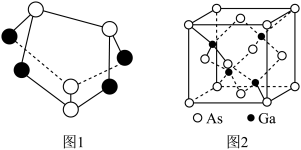
(1)基态砷原子的价电子轨道排布图为
(2) S、P和N三种元素第一电离能由大到小的顺序是
(3) 雄黄(As4S4)的结构如图1所示,S原子的杂化形式为
(4) SO2分子中的
 键数为
键数为 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则SO2中的大
),则SO2中的大 键应表示为
键应表示为(5)砷化镓是优良的半导体材料,密度为
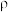 g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏伽德罗常数值为NA,则砷化镓晶体的空间利用率为
g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏伽德罗常数值为NA,则砷化镓晶体的空间利用率为
您最近一年使用:0次
2019-04-30更新
|
732次组卷
|
3卷引用:山东省郓城一中等学校2019届高三第三次模拟考试理科综合化学试题



