名校
解题方法
1 . 有A、B、C、D四种主族元素,原子序数依次增大,A元素原子 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:
(1)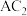 分子中含有
分子中含有___________ 个 键,属于
键,属于___________ (填“极性”或“非极性”)分子。
(2)B的简单气态氢化物的立体构型为___________ , 原子采用
原子采用___________ 杂化。
(3)写出 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:___________ 。
(4)C元素的电负性___________ (填“>”“<”或“=”)D元素的电负性,用一个化学方程式表示:___________ 。
 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入 轨道后,
轨道后, 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:(1)
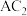 分子中含有
分子中含有 键,属于
键,属于(2)B的简单气态氢化物的立体构型为
 原子采用
原子采用(3)写出
 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:(4)C元素的电负性
您最近一年使用:0次
2023-05-02更新
|
122次组卷
|
3卷引用:河北省衡水市武强中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
2 . 化合物XYZ4ME4可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M同周期,E在地壳中含量最多。下列说法正确的是
| A.元素电负性:E>Y>Z | B.1mol M中含有共价键数目为4NA |
| C.半径:X2+>E2- | D.YZ3和YE 的空间结构均为三角锥形 的空间结构均为三角锥形 |
您最近一年使用:0次
3 . 有四种短周期元素,A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂;B与A周同期,其最高价氧化物的水化物呈两性,C元素的气态氢化物极易溶于水,可用作制冷剂;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂。下列说法错误的是
| A.A是短周期中电负性最小的元素 |
B.A、B、C离子半径由大到小的顺序为: |
| C.D所在周期第一电离能最大的元素为Ar |
D.通常用电解熔融的 来制取B 来制取B |
您最近一年使用:0次
4 . 化合物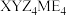 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是
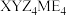 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是A.元素电负性: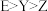 | B.氢化物沸点: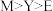 |
C.第一电离能: | D.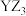 和 和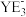 的空间结构均为三角锥形 的空间结构均为三角锥形 |
您最近一年使用:0次
2023-07-04更新
|
8027次组卷
|
15卷引用:河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题
河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题2023年高考广东卷化学真题(已下线)2023年广东卷高考真题变式题(选择题11-16)(已下线)第19讲元素周期律与元素周期表江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省江门市第一中学2023-2024学年高二上学期第一次段考化学试题(已下线)选择题1-5陕西师范大学附属中学2023-2024学年高二上学期期中考试化学试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)重庆市第七中学校2023-2024学年高三上学期月考(12月)化学试题安徽省合肥市第七中学2023-2024学年高二下学期第一次段考化学试卷 四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题甘肃省白银市靖远县第四中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
5 . 有四种短周期元素,它们的结构、性质等信息如表所述:
(1)基态A原子的核外电子排布式为_______
(2)A、B、C离子半径由大到小的顺序为:_______ ( 填元素符号)
(3)基态C原子的核外电子排布图是_______ ,其原子核外有_______ 个未成对电子,能量最高的电子为_______ 轨道 上的电子,其轨道呈_______ 形。
(4)D所在周期第一电离能最大的元素名为_______ ,该周期电负性最大的元素符号为_______ 。
(5)用电子式表示AD化合物的形成过程_______ 。
(6)CD3分子中含有的σ 键类型为_______ σ键。 (填s-s;s-p: p-p)
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A周同期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)基态A原子的核外电子排布式为
(2)A、B、C离子半径由大到小的顺序为:
(3)基态C原子的核外电子排布图是
(4)D所在周期第一电离能最大的元素名为
(5)用电子式表示AD化合物的形成过程
(6)CD3分子中含有的σ 键类型为
您最近一年使用:0次
名校
解题方法
6 . 硫氰酸甲基铵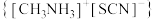 用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(
用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(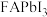 )和一种新型光电材料铯铜卤化物
)和一种新型光电材料铯铜卤化物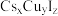 。请回答下列问题:
。请回答下列问题:
(1)基态Cu原子的电子排布式为_______ 。基态I原子的价电子排布图为_______ 。
(2)硫氰酸甲基铵所含元素中第一电离能最大的是_______ (填元素符号)。
(3)Cs、Cu、I的电负性由大到小的顺序是_______ 。
(4)甲脒( )与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是
)与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是_______ 。甲脒中碳原子的杂化方式为_______ 。
(5)水中铅的测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(结构如图)。
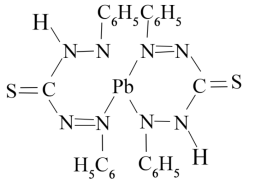
①该络合物可溶于四氯化碳,其晶体类型为_______ 。
②该络合物分子内不存在的微粒间作用力有_______ (填标号)。
a. 键 b.
键 b. 键 c.非极性键 d.离子键 e.配位键
键 c.非极性键 d.离子键 e.配位键
(6)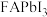 的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为
的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为_______ 。
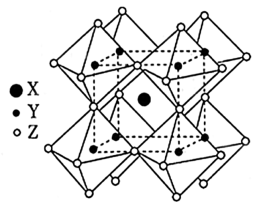
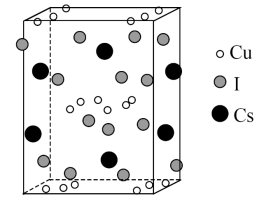
(7)某铯铜碘化物的晶胞如图所示,其晶胞参数为a nm,b nm和c nm,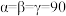 °,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为
°,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为_______  。
。
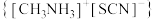 用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(
用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(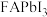 )和一种新型光电材料铯铜卤化物
)和一种新型光电材料铯铜卤化物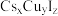 。请回答下列问题:
。请回答下列问题:(1)基态Cu原子的电子排布式为
(2)硫氰酸甲基铵所含元素中第一电离能最大的是
(3)Cs、Cu、I的电负性由大到小的顺序是
(4)甲脒(
 )与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是
)与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是(5)水中铅的测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(结构如图)。

①该络合物可溶于四氯化碳,其晶体类型为
②该络合物分子内不存在的微粒间作用力有
a.
 键 b.
键 b. 键 c.非极性键 d.离子键 e.配位键
键 c.非极性键 d.离子键 e.配位键(6)
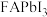 的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为
的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为
(7)某铯铜碘化物的晶胞如图所示,其晶胞参数为a nm,b nm和c nm,
 °,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为
°,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为 。
。
您最近一年使用:0次
2022-03-08更新
|
410次组卷
|
2卷引用:河北省部分名校2021-2022学年高三下学期3月份联考考试化学试题
解题方法
7 . 短周期主族元素X、Y、Z、W的原子序数依次增大,元素Y是地壳中含量最多的元素,X与Z同主族且二者可形成离子化合物,W的最外层电子数是其电子层数的2倍。下列说法正确的是
| A.电负性:X<W<Y | B.第一电离能:Z<W<Y |
| C.元素W的含氧酸均为强酸 | D.Z的氧化物对应的水化物为弱碱 |
您最近一年使用:0次
名校
8 . 已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的原子序数依次增大。A是宇宙中含量最丰富的元素,B、D原子的L层有2个未成对电子。E3+离子M层3d轨道电子为半满状态,F比E原子序数大1且位于同一族。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出F的价电子排布图_______ ,E位于周期表____ 区。
(2)B、C、D的电负性由小到大的顺序为___________ 。
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是_______ (填结构简式)
(4)F可形成分子式均为F(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则这种配合物的化学式为_______
(5)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞平均含有___ 个B原子。
(1)写出F的价电子排布图
(2)B、C、D的电负性由小到大的顺序为
(3)A、B、D三种元素可以形成组成为A2BD、A4BD、A2BD2的分子,其中B原子采取sp3 杂化的是
(4)F可形成分子式均为F(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时产生淡黄色沉淀,则这种配合物的化学式为
(5)B元素在自然界有多种同素异形体,硬度最大晶体中每个晶胞平均含有
您最近一年使用:0次
名校
解题方法
9 . 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2•2CO•2H2O
(1)X基态原子的电子排布式为______ .
(2)C、H、O三种原子的电负性由大到小的顺序为______ .
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:
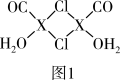
①与CO为互为等电子体的分子是______ .
②该配合物中氯原子的杂化方式为______ .
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______ .
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______ .XCl的化学式__________

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=_____________ (无需化简,列式即可)。
(1)X基态原子的电子排布式为
(2)C、H、O三种原子的电负性由大到小的顺序为
(3)X2Cl2•2CO•2H2O是一种配合物,其结构如图1所示:

①与CO为互为等电子体的分子是
②该配合物中氯原子的杂化方式为
③在X2Cl2•2CO•2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为

已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加 德罗常数NA=
您最近一年使用:0次
名校
10 . A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是
| A.四种元素A、B、C、D分别为O、Ca、Na、Ar |
| B.元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 |
| C.元素A、C简单离子的半径大小关系为A<C |
| D.元素B、C电负性大小关系为B>C |
您最近一年使用:0次
2016-12-09更新
|
520次组卷
|
12卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1(已下线)2011-2012学年福建省厦门一中高二上学期期中考试化学试卷(已下线)2013-2014学年福建省厦门一中高二上学期期中考试化学试卷2016-2017学年宁夏银川市第二中学高二下学期第一次月考化学试卷云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题(已下线)专题11.1 原子结构与性质(练)-《2020年高考一轮复习讲练测》云南省凤庆县第一中学2019-2020学年高二12月月考化学试题(已下线)第35讲 原子结构与性质(精练)-2021年高考化学一轮复习讲练测甘肃省静宁县第一中学2020-2021学年高二上学期期末考试化学(实验班)试题(已下线)模块同步卷02 原子结构与元素的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)吉林省长春市实验中学2020-2021学年度高二下学期阶段考试化学试题云南省玉溪市易门县一中2021-2022学年高二下学期3月月考化学试题



