名校
1 . 2022年诺贝尔化学奖授予了点击化学领域的三位科学家。一价铜催化的叠氮化物-炔烃环加成反应可谓点击化学中的第一个经典之作,催化剂CuCl的晶体结构如图所示,下列说法错误的是
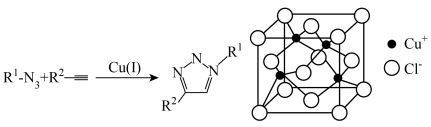

| A.N、O、Cu的电负性从大到小的顺序是N>O>Cu |
B.基态 的简化电子排布式为 的简化电子排布式为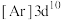 |
C.晶胞结构中, 的配位数为4 的配位数为4 |
D.若晶体的密度为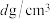 ,则晶胞参数 ,则晶胞参数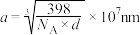 |
您最近一年使用:0次
名校
2 . ZnS荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方ZnS的晶胞如图所示,其晶胞参数为 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是
| A.电负性:Zn>S |
| B.S元素在元素周期表中位于s区 |
C.基态Zn原子的价层电子排布式为 |
D.立方ZnS晶体密度为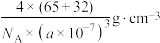 |
您最近一年使用:0次
2023-07-29更新
|
255次组卷
|
3卷引用:选择题11-14
3 . 光电材料[氟代硼铍酸钾晶体(KBe2BO3F2)、CaTiO3等]是目前科学家特别关注的材料。KBe2BO3F2(晶胞结构如图a,其中氧原子已省略,图a中的原子分别位于晶胞的顶点、棱及面上)是一种可制造出深紫外固体激光器的光电材料,可由BeO、KBF4和B2O3在一定条件下制得,同时放出BF3气体;CaTiO3(晶胞结构如图b)在光、电、热等领域有着独特的性质特征。
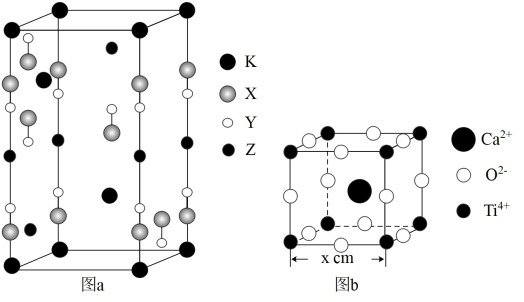
(1)基态Ti原子的核外电子排布式为____ 。
(2)KBF4是离子化合物,BF3、BF 中B原子的杂化方式依次为
中B原子的杂化方式依次为____ 、____ 。
(3)KBe2BO3F2的组成元素中,非金属元素的电负性由强到弱的顺序为____ (填元素符号),基态原子的第一电离能:Be____ (填“>”或“<”)B。
(4)图a中,已知原子半径X>Y,X、Z分别表示____ 、____ 。(填元素符号)
(5)图b中,与Ti4+最近且距离相等的氧离子构成的几何图形为____ ,若设晶胞边长为xcm,则Ti4+与最近的 间的距离为
间的距离为____ (填含x的表达式)cm;表示该晶体的晶胞还可以有另一种画法,将Ca2+置于立方体的顶点,则Ti4+的位置是____ 。

(1)基态Ti原子的核外电子排布式为
(2)KBF4是离子化合物,BF3、BF
 中B原子的杂化方式依次为
中B原子的杂化方式依次为(3)KBe2BO3F2的组成元素中,非金属元素的电负性由强到弱的顺序为
(4)图a中,已知原子半径X>Y,X、Z分别表示
(5)图b中,与Ti4+最近且距离相等的氧离子构成的几何图形为
 间的距离为
间的距离为
您最近一年使用:0次
解题方法
4 . 化合物A (结构如下图)由原子序数依次增大的X、Y、Z、W短周期元素组成,常用来做金属矿物的浮选剂。已知Z与W位于不同周期。下列说法正确的是


| A.四种元素中X的电负性最小 |
| B.最简单气态氢化物的稳定性:Z<Y |
| C.W位于周期表的第二周期VIA族 |
| D.四种元素可组成既含离子键又含共价键的化合物 |
您最近一年使用:0次
2023-02-14更新
|
313次组卷
|
2卷引用:河北省唐山市2022-2023学年高二上学期期末考试化学试题
2022·河北·模拟预测
5 . 硼及其化合物是用途广泛的化工原料,可以应用于新型材料的制备。回答下列问题:
(1)基态硼原子的价电子排布式为___________ ;与硼同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________ 。
(2)碳化硼(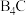 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于___________ 晶体。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)自然界中含硼钠盐是一种天然矿藏,其化学式为 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________ (填标号)。
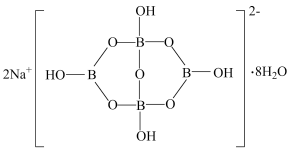
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4) 的空间构型为
的空间构型为___________ , 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因___________ 。
(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有___________ ,组成该有机物的第二周期元素电负性由大到小的顺序为___________ 。

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为___________ (填标号)。

②若晶胞的边长为apm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为___________  (列出计算表达式)。
(列出计算表达式)。
(1)基态硼原子的价电子排布式为
(2)碳化硼(
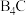 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)自然界中含硼钠盐是一种天然矿藏,其化学式为
 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4)
 的空间构型为
的空间构型为 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为

②若晶胞的边长为apm,阿伏加德罗常数的值为
 ,则晶体的密度为
,则晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
6 . 下列说法正确的是
| A.同一周期的元素中,第VIIA族元素的第一电离能最大 |
| B.中心原子是sp杂化的分子,其空间结构不一定为直线形 |
| C.电负性大于1.8的元素一定为非金属元素,小于1.8的一定为金属元素 |
| D.基态Mg原子失去第一个电子吸收的能量大于失去第二个电子吸收的能量 |
您最近一年使用:0次
2022-02-22更新
|
291次组卷
|
4卷引用:河北省邢台市四校联考2021-2022学年高二下学期第二次月考化学试题
名校
7 . 下列说法错误的是
A. 的空间结构模型为 的空间结构模型为 |
B.钠、镁、铝三种元素的电负性和第一电离能由小到大的顺序均为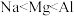 |
C.过氧化钠的电子式为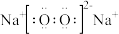 |
D.基态硫原子的价层电子排布图为 |
您最近一年使用:0次
名校
解题方法
8 . 完成下列问题
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第_______ 周期第_______ 族。
②基态C原子核外电子排布式为_______ ;基态N原子核外有_______ 种运动状态的电子。
③基态Si原子核外电子占据的最高能级的电子云轮廓图为_______ 形。
④Mg、Al 两种元素中第一电离能较大的是_______ (填元素符号),原因为_______ 。
(2)几种元素的电负性数据如下表:
①AlF3的熔点_______ AlBr3的熔点(填“大于”、“小于”或“等于”),原因是_______ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_______ 。
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为_______ 。
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第
②基态C原子核外电子排布式为
③基态Si原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al 两种元素中第一电离能较大的是
(2)几种元素的电负性数据如下表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为
您最近一年使用:0次
名校
9 . 下列说法正确的是
| A.电负性越大的元素对键合电子的吸引力强,其第一电离能也越大 |
B. 与 与 两种离子的空间构型相同,但其中心原子的杂化方式不同 两种离子的空间构型相同,但其中心原子的杂化方式不同 |
| C.H2O2与C2H2均为既含σ键又含π键的非极性分子 |
| D.NH3的稳定性强于AsH3的原因为NH3存在分子间氢键 |
您最近一年使用:0次
名校
解题方法
10 . 回答问题
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了Al、Cr、Cu、C、N、O、Si等多种元素。上述元素中基态原子未成对电子数与Al相同的有___________ 。
(2)元素铋主要用于制造易熔金属合金,元素Bi位于第6周期VA族,其基态原子的价电子排布式为___________ 。Bi(NO3)3∙5H2O中各元素电负性从大到小的顺序为___________ 。
(3)N、P、As均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
①下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________ (填序号,下同),未成对电子最多的是___________ 。
a. 1s22s22p3 b. 1s22s2 c. 1s22s12p4 d. 1s2s12p3
②Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了Al、Cr、Cu、C、N、O、Si等多种元素。上述元素中基态原子未成对电子数与Al相同的有
(2)元素铋主要用于制造易熔金属合金,元素Bi位于第6周期VA族,其基态原子的价电子排布式为
(3)N、P、As均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
①下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a. 1s22s22p3 b. 1s22s2 c. 1s22s12p4 d. 1s2s12p3
②Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是
您最近一年使用:0次



