名校
解题方法
1 . 结构决定性质,下列关于化学事实及其解释不正确的是
A.卤化氢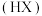 的沸点随着原子序数增大而增大,原因是分子间作用力增大 的沸点随着原子序数增大而增大,原因是分子间作用力增大 |
B. 分子可以稳定存在,原因是共价键键能大 分子可以稳定存在,原因是共价键键能大 |
C. 的酸性比 的酸性比 强,原因是 强,原因是 的电负性比 的电负性比 大,导致 大,导致 的羧基中的羟基极性更大 的羧基中的羟基极性更大 |
D.乙烯容易发生加成反应,原因是碳原子间形成的 键键能小容易断裂 键键能小容易断裂 |
您最近一年使用:0次
解题方法
2 . 我国科学家发现AgCrS2 (AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有___________ 个电子顺时针旋转。基态铬原子有___________ 个未成对电子。
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是___________ (填元素符号)。
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。 的空间构型为
的空间构型为___________ ,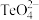 中碲的杂化类型是
中碲的杂化类型是___________ 。
③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是___________ 。
(3)配合物 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为___________ 。(Cr与O、N均形成了配位键)
(4)在银氨溶液中,1 mol 中含
中含___________ molσ键。
(5)复合材料氧铬酸钙的立方晶胞如图所示。
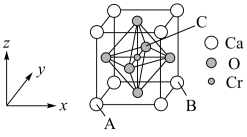
①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为___________ 。
②1个钙原子与___________ 个氧原子等距离且最近。
③该晶体密度为___________  (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。
 的空间构型为
的空间构型为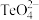 中碲的杂化类型是
中碲的杂化类型是③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是
(3)配合物
 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为(4)在银氨溶液中,1 mol
 中含
中含(5)复合材料氧铬酸钙的立方晶胞如图所示。

①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为
②1个钙原子与
③该晶体密度为
 (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
您最近一年使用:0次
2021-12-03更新
|
558次组卷
|
3卷引用:河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三12月联考化学试题
河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三12月联考化学试题河南省新乡市2021-2022学年高三上学期第一次模拟考试理综化学试题 (已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
3 . 物质的结构决定其性质.下列事实与解释不相符的是
选项 | 事实 | 解释 |
A | 基态Cu原子价层电子排布式为3d104s1 | 3d能级电子为全充满状态,原子能量更低 |
B | 水的热稳定性强于氨 | 水分子间形成的氢键数目与强度均大于氨 |
C | 三氟乙酸的酸性强于乙酸 | 氟为吸电子基,导致羟基中O-H键极性变大 |
D | Na2O、MgO、Al2O3离子键成分的百分数依次减小 | Na、Mg、Al的电负性依次增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-06-01更新
|
196次组卷
|
2卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
解题方法
4 . M(结构如图)常用作农药中间体、橡胶助剂、合成树脂添加剂以及分析试剂等。X、Y、Z、W为短周期原子序数依次增大的主族元素,其中基态X原子内的电子只有1个运动状态,Y、Z位于X的下一周期,基态W原子s和p能级电子数之比为3:5。下列说法正确的是

| A.元素电负性:W>Z>Y | B.元素第一电离能:Y>Z>W |
| C.M分子中Y原子的孤电子对数为0 | D.M分子中σ键和π键数目之比为4:1 |
您最近一年使用:0次
2024-03-23更新
|
144次组卷
|
2卷引用:河北省邢台市名校质检联盟2023-2024学年高二上学期12月月考化学试题
名校
解题方法
5 . 有机化合物 和
和 发生水解时的主要反应分别是
发生水解时的主要反应分别是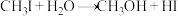 和
和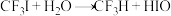 ,下列说法正确的是
,下列说法正确的是
 和
和 发生水解时的主要反应分别是
发生水解时的主要反应分别是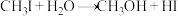 和
和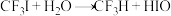 ,下列说法正确的是
,下列说法正确的是| A.电负性:F>O>C>H |
| B.可用乙醇萃取碘水中的碘 |
C.F元素的最高价氧化物对应的水化物的化学式: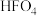 |
| D.H元素和I元素之间通过离子键形成HI |
您最近一年使用:0次
解题方法
6 . 一种钠盐的结晶水合物全部由短周期元素构成,其阴离子的结构如图:
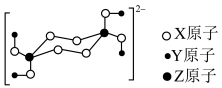
已知X无最高正化合价,三种元素中Y的原子半径最小,X和Z同周期,下列说法正确的是

已知X无最高正化合价,三种元素中Y的原子半径最小,X和Z同周期,下列说法正确的是
| A.X不存在同素异形体 |
| B.该阴离子结构中含有配位键 |
| C.X、Y、Z三种元素中电负性最大的是Z |
| D.该钠盐不具有强氧化性 |
您最近一年使用:0次
2023-09-06更新
|
137次组卷
|
2卷引用:河北省邯郸市2024届高三上学期第一次调研监测化学试题
名校
7 . 甲醇(CH3OH)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为2CH3OH+O2 2
2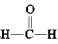 +2H2O
+2H2O
(1)C、H、O 三种元素的电负性由大到小的顺序为___________ 。
(2)H2O的中心原子上的孤电子对数为___________ 。
(3)HCHO分子内σ键与π键个数之比为___________ ,HCHO的空间结构为___________ 。
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为___________ 和___________ 。
(5)甲醇氧化生成HCHO时,会产生CO、CO2、CH3OCH3等副产物。相同条件下,CO2的沸点比O2的高,主要原因为___________ 。
(6)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:___________ 。
 2
2 +2H2O
+2H2O(1)C、H、O 三种元素的电负性由大到小的顺序为
(2)H2O的中心原子上的孤电子对数为
(3)HCHO分子内σ键与π键个数之比为
(4)CH3OH和HCHO分子中碳原子的杂化轨道类型分别为
(5)甲醇氧化生成HCHO时,会产生CO、CO2、CH3OCH3等副产物。相同条件下,CO2的沸点比O2的高,主要原因为
(6)工业上利用甲醛易溶于水的性质吸收产品,解释甲醛易溶于水的原因:
您最近一年使用:0次
2021-07-11更新
|
451次组卷
|
5卷引用:河北省张家口市张北县第一中学2022-2023学年高二下学期4月月考化学试题
解题方法
8 . 能引起痛风的某有机物的结构如图所示,其中短周期元素Q、X、Y、Z、M的原子序数依次增大,Q、M同主族,X、Y、Z三种元素位于同一周期相邻主族。下列说法正确的是
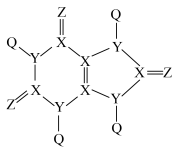
| A.Y的基态原子有3个单电子 | B.简单离子半径: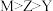 |
C.元素的电负性: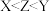 | D.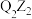 与 与 中的化学键类型相同 中的化学键类型相同 |
您最近一年使用:0次
2024-04-03更新
|
128次组卷
|
2卷引用:河北省部分学校2024届高三下学期二轮复习联考(一)新高考卷化学试题
名校
解题方法
9 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
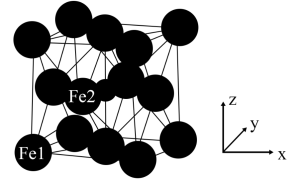
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
289次组卷
|
5卷引用:石家庄示范性高中2022届高三上学期调研考试化学试题
名校
10 . 由于钒的化合物颜色鲜艳而多彩,因此以神话中斯堪的纳维亚女神“Vanadis"的名字命名。钒有多种化合价,如:+2、+3、+4、+5等,其化合物具有广泛的用途。请回答下列问题:
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为___________ 。
(2)钒的一种配合物的结构简式为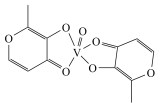 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是_______ (用元素符号表示),氧原子的杂化轨道类型为__________ ,该配合物分子中含有的化学键类型有________ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是_____________ (用分子式表示),原因为________ 。
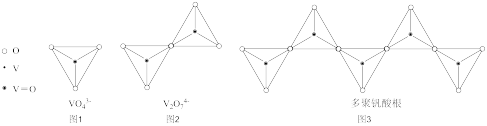
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为__ 。
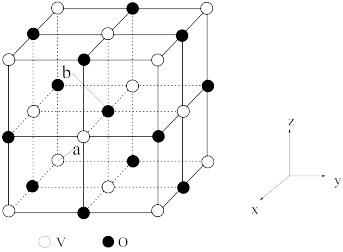
(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为________________________ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,若a点原子的分数坐标为(0,0,0),则b点原子的分数坐标为____________________ ;钒原子构成的八面体空隙与氧原子构成的八 面体空隙的数量比为_________________________ ;已知该氧化物晶体的密度为ρg·cm-3。则晶胞中距离最近的两个氧原子的核间距为_________________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。
(1)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 ,表示,与之相反的用 -
,表示,与之相反的用 - 表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为
表示,称为电子的自旋磁量子数,则基态V3+核外电子的自旋磁量子数之和为(2)钒的一种配合物的结构简式为
 ,该配合物的组成元素的电负性由大到小的顺序是
,该配合物的组成元素的电负性由大到小的顺序是A.离子键 B.极性键 C.非极性键 D.配位键
(3)钒的含氧酸有正钒酸(H3VO4)、偏钒酸(HVO3)等,正钒酸、偏钒酸的酸性由强到弱的顺序是
(4)钒的多种含氧酸根离子的结构如图所示,图3为一种无限长单链结构的多聚钒酸根,其化学式为

(5)钒的某种氧化物的立方晶胞如图所示,该氧化物的化学式为

您最近一年使用:0次



