解题方法
1 . 金属原子与CO形成的配合物称为金属羰基配合物,金属羰基配合物中每个CO提供一对电子与金属原子形成配位键,且金属原子的外围电子与CO提供的电子总和等于18。羰基铁[Fe(CO)5]的结构如图所示,其熔点为-21℃,沸点为102.8℃,回答下列问题。
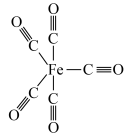
(1)基态Fe原子外围电子轨道表示式为_______ ,Fe(CO)5属于_____ 晶体。
(2)98gFe(CO)5中σ键的数目为_____ NA;Fe(CO)5中铁的配位数为_____ ,配位原子为_____ 。
(3)羰基镍的化学式为______ ,Ni、C、O的电负性由大到小的顺序为______ 。
(4)氯化羰基亚铜的结构为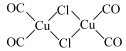 ,其中铜元素的化合价为
,其中铜元素的化合价为_____ ,标出氯化羰基亚铜中Cu周围的化学键:_____ (须用“→”表示配位键)。

(1)基态Fe原子外围电子轨道表示式为
(2)98gFe(CO)5中σ键的数目为
(3)羰基镍的化学式为
(4)氯化羰基亚铜的结构为
 ,其中铜元素的化合价为
,其中铜元素的化合价为
您最近一年使用:0次
名校
2 . 下列有关物质结构与性质的理解正确的是
| A.电负性大的元素,其第一电离能一定大 |
| B.σ键存在于所有分子中 |
C. 、 、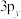 、 、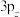 三个轨道相互垂直,能量相等 三个轨道相互垂直,能量相等 |
| D.干冰和冰的结构表明范德华力和氢键通常都具有方向性 |
您最近一年使用:0次
解题方法
3 . 铜及其化合物有许多特殊用途,最近科研人员用CuP2作电极电催化CO2,CO2经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为Cu3(PO4)2和Cu2O。回答下列问题:。
(1)基态磷原子的价电子排布图为___________ ,基态Cu原子电子占据最高能级的电子云轮廓图为___________ 形。
(2)Cu、O、P三种元素中,电负性由大到小的顺序为___________ ,C、O、P最简单氢化物的沸点由大到小的顺序为___________ 。(用“>”连接氢化物化学式)。
(3) 的空间构型为
的空间构型为___________ ,其中P采取___________ 杂化方式。
(4)1-丁醇、1-氯丁烷的沸点依次为118°C、78.2°C,前者沸点较高的原因是___________ 。
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为___________ (用含a、NA的代数式表示);P、Q间的距离为___________ pm。
(1)基态磷原子的价电子排布图为
(2)Cu、O、P三种元素中,电负性由大到小的顺序为
(3)
 的空间构型为
的空间构型为(4)1-丁醇、1-氯丁烷的沸点依次为118°C、78.2°C,前者沸点较高的原因是
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为
您最近一年使用:0次
4 . 甲醛检测试剂盒常用来检测室内空气中甲醛,其原理是甲醛与MBTH反应生成物质A,物质A再发生一系列反应,最终生成蓝绿色化合物,有关转化如图。下列说法正确的是


| A.上述有机物涉及的元素中氮元素的电负性最强 |
| B.甲醛分子结构为平面三角形 |
| C.物质A中的C、N、S一定位于同一个平面内 |
| D.1molMBTH中σ键的数目为22NA |
您最近一年使用:0次
5 . 有机物M(如图所示)是合成某新型绿色农药的中间体,下列说法正确的是
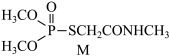
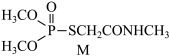
A.中子数为8的碳原子: | B.电负性: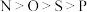 |
C.碳原子的杂化方式为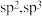 | D.简单离子半径: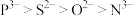 |
您最近一年使用:0次
2023-04-24更新
|
121次组卷
|
3卷引用:河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题
名校
解题方法
6 . 短周期x、y、z、m、n五种主族元素,原子序数依次增大,x元素的某种原子可以在考古时用来测定文物年代。常温时,测得0.1mol/L y、m、n简单氢化物的水溶液pH分别为11、4、1。且z、m还可以与Na形成如图所以结构的化合物。以下有关说法错误的是
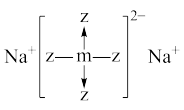
| A.原子半径:z<m<n |
| B.简单氢化物的沸点:x<y<z |
| C.电负性:z>y>x |
| D.x的最高价氧化物中各原子均满足8e-稳定结构 |
您最近一年使用:0次
2022-03-06更新
|
231次组卷
|
2卷引用:河北省邯郸市2021~2022学年高二上学期期末考试化学试题
7 . 重水是含有较多 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:
(1)画出Ca原子的原子结构示意图___________ ,硫元素在元素周期表的位置___________ ,属于___________ 区。
(2)写出基态N原子的电子排布式___________ ,画出基态O原子的价电子排布图___________ 。基态N原子的第一电离能比O原子的要大的原因是___________ 。
(3)若将基态镁原子最高能级的电子排布图表示为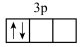 ,则它违背的电子排布规律是
,则它违背的电子排布规律是___________ 、___________ ,基态硫原子核外电子所处最高能级轨道的形状为___________ 。
(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
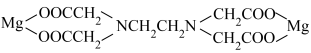
其中C、N、O、Mg四种元素的电负性由大到小的顺序是___________ ,原子半径最大的是___________ (填元素符号,下同),四种元素中基态原子核外单电子数最多的是___________ 。
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式___________ 、___________ 。
 和
和 的水,重水对工农业生成有很大危害,其中含有
的水,重水对工农业生成有很大危害,其中含有 和
和 的重水叫暂时硬水,含有
的重水叫暂时硬水,含有 、
、 、
、 和
和 等的重水叫永久硬水,回答下面问题:
等的重水叫永久硬水,回答下面问题:(1)画出Ca原子的原子结构示意图
(2)写出基态N原子的电子排布式
(3)若将基态镁原子最高能级的电子排布图表示为
 ,则它违背的电子排布规律是
,则它违背的电子排布规律是(4)EDTA是硬水软化常用的化学试剂,与镁离子结合为
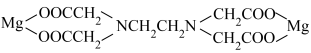
其中C、N、O、Mg四种元素的电负性由大到小的顺序是
(5)钙元素与铬元素、铜元素位于同一周期,写出铬、铜基态原子的价电子排布式
您最近一年使用:0次
名校
解题方法
8 . VCU研发的锂超离子导体Li3SBF4,提升了固态电解质导电性,其制备反应为LiBF4+Li2S=Li3SBF4。
回答下列问题:
(1)基态硫原子中核外电子有____ 种运动状态;组成锂超离子导体的四种元素中,电负性最大的元素的价层电子排布式为____ 。
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是____ (填化学式),该分子的中心原子的价层电子对数是____ ;含F有机酸CF3COOH比CCl3COOH的酸性____ (填“强”或“弱”),原因为____ 。
(3)BF3与F-形成 时,二者形成的化学键为
时,二者形成的化学键为____ 键,提供电子对的原子为____ (填元素符号), 中B的杂化方式为
中B的杂化方式为____ 。
(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为___ 、___ ;设NA为阿伏加德罗常数的值,LiFePO4的密度ρ=___ g•cm-3(用含a、b、c、NA的代数式表示)。
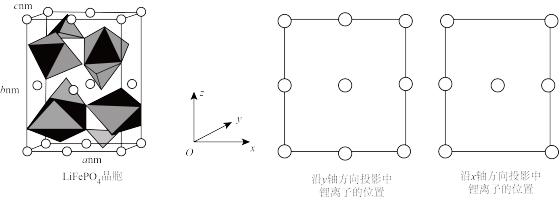
回答下列问题:
(1)基态硫原子中核外电子有
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是
(3)BF3与F-形成
 时,二者形成的化学键为
时,二者形成的化学键为 中B的杂化方式为
中B的杂化方式为(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为

您最近一年使用:0次
9 . 四氯化钛( )主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取
)主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取 ,反应的化学方程式为
,反应的化学方程式为
 。请回答下列问题:
。请回答下列问题:
(1)基态钛原子的电子排布式为___________ ,其未成对电子数为___________ 。
(2)已知:H、 、
、 的电负性分别为2.1、3.0、1.5,则
的电负性分别为2.1、3.0、1.5,则 中
中 和
和 之间的化学键类型为
之间的化学键类型为___________ , 中
中 的化合价为
的化合价为___________ 。
(3)基态碳原子中,能量最高的电子位于___________ 轨道,该轨道有___________ 个伸展方向,轨道形状为___________ 。
(4)若用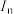 表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
表示元素的第n电离能,碳元素的电离能变化趋势如图所示:

 与
与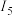 的差值明显大于其他相邻电离能的差值,原因是
的差值明显大于其他相邻电离能的差值,原因是___________ 。
(5)基态铁原子的外围电子轨道表示式为___________ 。 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为___________ 。
 )主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取
)主要用于制取海绵钛和钛白粉,也可用作催化剂。工业上以钛铁矿、焦炭、氯气为原料,在高温条件下制取 ,反应的化学方程式为
,反应的化学方程式为
 。请回答下列问题:
。请回答下列问题:(1)基态钛原子的电子排布式为
(2)已知:H、
 、
、 的电负性分别为2.1、3.0、1.5,则
的电负性分别为2.1、3.0、1.5,则 中
中 和
和 之间的化学键类型为
之间的化学键类型为 中
中 的化合价为
的化合价为(3)基态碳原子中,能量最高的电子位于
(4)若用
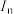 表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
表示元素的第n电离能,碳元素的电离能变化趋势如图所示:
 与
与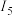 的差值明显大于其他相邻电离能的差值,原因是
的差值明显大于其他相邻电离能的差值,原因是(5)基态铁原子的外围电子轨道表示式为
 的稳定性强于
的稳定性强于 ,从微观角度解释其原因为
,从微观角度解释其原因为
您最近一年使用:0次
名校
10 . A、B、C、D、E 五种元素在周期表中的相对位置如图所示,下列说法正确的是
A | B | ||||
C | D | E |
| A.C的简单离子是它所在周期元素中离子半径最小的离子 |
| B.D和E两元素的氧化物对应水化物的酸性E>D |
| C.B是周期表中电负性最强的元素 |
| D.该五种元素中第一电离能由大到小进行排序为:B>A>E>D>C |
您最近一年使用:0次



