解题方法
1 . 反应SiHCl3(g)+H2(g)=Si(s)+3HCl(g)可用于纯硅的制备,下列说法正确的是
| A.SiHCl3中Si原子的杂化方式为sp2杂化 |
| B.SiHCl3中Si元素的化合价为+2 |
| C.键长:Si-Si>C-C,故键能:Si-Si<C-C |
| D.HCl易溶于水是因为HCl和水分子之间能形成氢键 |
您最近一年使用:0次
名校
2 . 下列是某同学学习相关知识后总结的规律,其中错误的是
A.Zn、Fe、Cu单质活泼性依次减弱, 、 、 、 、 氧化性依次增强 氧化性依次增强 |
B.一定温度下,一元弱酸HA的 越小,则NaA的 越小,则NaA的 越大 越大 |
C.电解时, 、 、 、 、 放电能力依次减弱, 放电能力依次减弱, 、 、 、 、 氧化性依次增强 氧化性依次增强 |
| D.元素的电负性越大,该原子的第一电离能越大 |
您最近一年使用:0次
解题方法
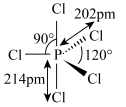
3 . 已知 的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时,
的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时, 发生自偶电离,在稀溶液中的主要反应为
发生自偶电离,在稀溶液中的主要反应为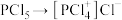 ,浓度较高时的主要反应为
,浓度较高时的主要反应为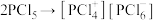 。下列说法正确的是
。下列说法正确的是
 的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时,
的结构式如图所示。其溶于极性溶剂(如硝基甲烷、硝基苯)时, 发生自偶电离,在稀溶液中的主要反应为
发生自偶电离,在稀溶液中的主要反应为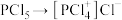 ,浓度较高时的主要反应为
,浓度较高时的主要反应为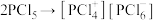 。下列说法正确的是
。下列说法正确的是
A. 中P满足8电子稳定结构 中P满足8电子稳定结构 | B.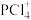 的空间构型为四面体形 的空间构型为四面体形 |
| C.P与Cl之间共用电子对偏向P | D. 属于非极性分子 属于非极性分子 |
您最近一年使用:0次
2023-06-12更新
|
66次组卷
|
2卷引用:河北省邯郸市永年区第二中学2022-2023学年高二下学期6月月考化学试题
名校
解题方法
4 . 人们发现,纸张会发生酸性腐蚀而变脆、破损,这严重威胁纸质文物的保存。经分析检验发现,酸性腐蚀主要与造纸中涂敷明矾的工艺有关,为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂。回答下列问题:
(1)上述涉及的物质中,原子序数最大的元素是___________ (填化学符号),其位于元素周期表中的___________ 区。
(2)H、C、O元素的电负性由大到小的顺序为___________ (用元素符号表示)。
(3)熔融 可生成具有挥发性的二聚体,二聚体
可生成具有挥发性的二聚体,二聚体 的结构式为
的结构式为___________ ,其中Al的配位数为___________ 。
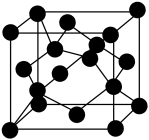
(4) 的一种晶胞结构如图所示。
的一种晶胞结构如图所示。

① 属于
属于___________ (填“离子”或“共价”)化合物。
②下列说法错误的是___________ (填标号)。
A. 晶体有较高的熔、沸点 B.
晶体有较高的熔、沸点 B. 晶体硬而脆
晶体硬而脆
C. 晶体易溶于水 D.
晶体易溶于水 D. 晶体不导电
晶体不导电
③若将 形成的立方体分割成8个小立方体,则每个小立方体的中心有
形成的立方体分割成8个小立方体,则每个小立方体的中心有___________ 个 。
。
(5)由碳元素形成的某种晶体的晶胞结构如图所示,设阿伏加德罗常数的值为 ,晶体的密度为
,晶体的密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为___________ (用含 、
、 的代数式表示)pm。
的代数式表示)pm。
(1)上述涉及的物质中,原子序数最大的元素是
(2)H、C、O元素的电负性由大到小的顺序为
(3)熔融
 可生成具有挥发性的二聚体,二聚体
可生成具有挥发性的二聚体,二聚体 的结构式为
的结构式为(4)
 的一种晶胞结构如图所示。
的一种晶胞结构如图所示。
①
 属于
属于②下列说法错误的是
A.
 晶体有较高的熔、沸点 B.
晶体有较高的熔、沸点 B. 晶体硬而脆
晶体硬而脆C.
 晶体易溶于水 D.
晶体易溶于水 D. 晶体不导电
晶体不导电③若将
 形成的立方体分割成8个小立方体,则每个小立方体的中心有
形成的立方体分割成8个小立方体,则每个小立方体的中心有 。
。(5)由碳元素形成的某种晶体的晶胞结构如图所示,设阿伏加德罗常数的值为
 ,晶体的密度为
,晶体的密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为 、
、 的代数式表示)pm。
的代数式表示)pm。
您最近一年使用:0次
2021-07-04更新
|
163次组卷
|
2卷引用:河北省石家庄市2020-2021学年高二下学期期末考试化学试题
解题方法
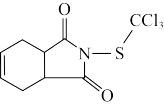
5 . 克菌丹是一种用于农作物的保护性杀菌剂,世界卫生组织公布其为致癌物,其结构简式如图所示。下列说法正确的是

| A.电负性:O>Cl>S | B.热稳定性: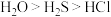 |
C.该分子中S采用 杂化 杂化 | D.酸性: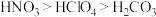 |
您最近一年使用:0次
6 . 镓、硅、锗、硒的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料。
(1)基态锗原子的电子排布式为___________ 。其属于元素周期表中的___________ 区元素。
(2)锗、砷、硒三种元素的第一电离能由大到小的顺序为___________ ,As与Cl能形成AsCl3和AsCl5两种化合物,但N与Cl只能形成NCl3一种化合物的原因为___________ 。
(3)硅能与氢元素形成丁硅烯(Si4H8),该分子中σ键与π键个数之比___________ 。
(4)GaCl3分子中Ga原子的杂化轨道类型为___________ ,GeCl4分子的空间构型为___________ 。与GeCl4互为等电子体的离子为___________ (写2种,写化学式)。
(1)基态锗原子的电子排布式为
(2)锗、砷、硒三种元素的第一电离能由大到小的顺序为
(3)硅能与氢元素形成丁硅烯(Si4H8),该分子中σ键与π键个数之比
(4)GaCl3分子中Ga原子的杂化轨道类型为
您最近一年使用:0次
解题方法
7 . 近年来,科学家研究的以复合过渡金属镍的氢氧化物为催化剂、三乙醇胺为电子给体以及 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。
(1)下列有关 原子的叙述正确的是
原子的叙述正确的是___________ (填标号)。
A.第一电离能比钙的大
B.基态 原子的核外价电子排布式为
原子的核外价电子排布式为
C.基态 原子形成基态
原子形成基态 时,先失去
时,先失去 轨道上的电子
轨道上的电子
(2)三乙醇胺的制备:3
 。
。
①三乙醇胺所含的元素中,电负性由小到大的顺序为___________ 。
② 的空间结构为
的空间结构为___________ 。
③键角:
___________ (填“ ”、“
”、“ ”或“
”或“ ”)
”) 。
。
(3) 能转化为高价值化学品,如
能转化为高价值化学品,如 、
、 、
、 。上述3种物质中,沸点最高的是
。上述3种物质中,沸点最高的是 ,原因是
,原因是___________ 。
(4) 的结构如图所示。
的结构如图所示。 原子的杂化类型为
原子的杂化类型为___________ , 配体
配体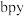 分子中含有
分子中含有 键的数目为
键的数目为___________  。
。
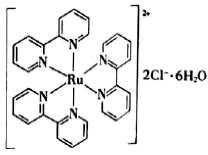
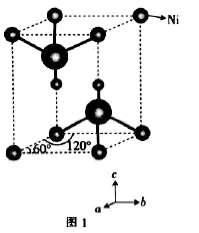
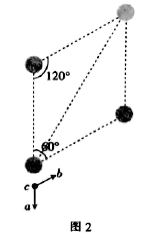
(5) 的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置
的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置___________ 。已知晶胞的底边长为 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为___________  (列出表达式)。
(列出表达式)。
 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。(1)下列有关
 原子的叙述正确的是
原子的叙述正确的是A.第一电离能比钙的大
B.基态
 原子的核外价电子排布式为
原子的核外价电子排布式为
C.基态
 原子形成基态
原子形成基态 时,先失去
时,先失去 轨道上的电子
轨道上的电子(2)三乙醇胺的制备:3

 。
。①三乙醇胺所含的元素中,电负性由小到大的顺序为
②
 的空间结构为
的空间结构为③键角:

 ”、“
”、“ ”或“
”或“ ”)
”) 。
。(3)
 能转化为高价值化学品,如
能转化为高价值化学品,如 、
、 、
、 。上述3种物质中,沸点最高的是
。上述3种物质中,沸点最高的是 ,原因是
,原因是(4)
 的结构如图所示。
的结构如图所示。 原子的杂化类型为
原子的杂化类型为 配体
配体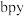 分子中含有
分子中含有 键的数目为
键的数目为 。
。
(5)
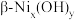 的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置
的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置 ,高为
,高为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为 (列出表达式)。
(列出表达式)。

您最近一年使用:0次
2021-08-29更新
|
108次组卷
|
2卷引用:河北省2022届高三上学期9月份开学摸底联考化学试题
解题方法
8 . 碳、氮和铬的相关化合物在药物化学及催化化学等领域应用广泛。请回答下列问题:
(1)基态铬原子价电子排布式为___ ,未成对电子数为___ 。
(2)铬的一种含氧酸——铬酸(H2CrO4),结构和硫酸类似。其阴离子CrO 的立体构型为
的立体构型为___ ,铬酸是一种二元强酸,原因是___ 。
(3)含铬的化合物吡啶甲酸铬是一种用于二型糖尿病的保健药,其结构如图所示。
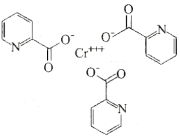
①该化合物中H、C、N、O的电负性由大到小的顺序为___ ,N原子的杂化轨道类型为___ 。
②该化合物中含有的化学键类型有___ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)铬的某种氧化物晶胞如图所示(灰球代表铬原子,黑球代表氧原子)。
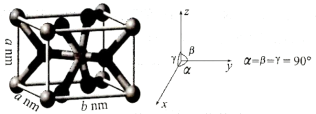
该氧化物的化学式为___ ,铬原子的配位数是___ ;该晶体的密度为___ g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即)。
(1)基态铬原子价电子排布式为
(2)铬的一种含氧酸——铬酸(H2CrO4),结构和硫酸类似。其阴离子CrO
 的立体构型为
的立体构型为(3)含铬的化合物吡啶甲酸铬是一种用于二型糖尿病的保健药,其结构如图所示。

①该化合物中H、C、N、O的电负性由大到小的顺序为
②该化合物中含有的化学键类型有
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
(4)铬的某种氧化物晶胞如图所示(灰球代表铬原子,黑球代表氧原子)。

该氧化物的化学式为
您最近一年使用:0次
名校
解题方法
9 . 一种可用作有机化工原料的化合物Q的结构如图。已知X、Y、Z、W、M为原子序数依次增大的主族元素,其中X的核电荷数等于其主族序数,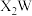 是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是
是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是
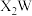 是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是
是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是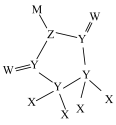
| A.原子半径:W>Z>Y | B.第一电离能:Z>W>Y |
| C.电负性:M>W>Z | D.键角: |
您最近一年使用:0次
2024-05-22更新
|
157次组卷
|
4卷引用:2024届河北省保定市十校高三下学期三模化学试题
解题方法
10 . 聚乙二醇(PEG)有良好的生物相容性,在水中可与 形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是
形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是

 形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是
形成氢键,由“中性聚合物”转变为超分子“聚电解质”,下列说法错误的是
A.PEG中 和 和 的杂化方式相同 的杂化方式相同 | B. 的VSEPR模型为四面体形 的VSEPR模型为四面体形 |
C.键角: | D.电负性: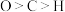 |
您最近一年使用:0次



