1 . 在常用退烧药中,对乙酰氨基酚(结构简式如图所示)是目前应用最广泛的OTC类药品之一,关于其分子结构中涉及的元素,下列说法错误的是
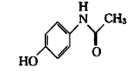

A.N2的电子式: | B.O2-的结构示意图: |
| C.第一电离能:N>O>C | D.电负性:O>N>C>H |
您最近一年使用:0次
2 . 3-乙基吡啶(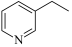 )是一种重要的有机合成中间体,具有芳香性。回答下列问题:
)是一种重要的有机合成中间体,具有芳香性。回答下列问题:
(1)3-乙基吡啶中所含元素电负性由大到小的顺序为____ ;其中碳原子的杂化方式为____ 。
(2)3-乙基吡的沸点高于2,6-二甲基吡啶(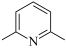 ),分析可能的原因为
),分析可能的原因为____ 。
(3)吡啶(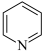 )的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与
)的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与____ molH2发生加成反应;3-乙基吡啶与浓硫酸、浓硝酸混合,在一定条件下发生硝化反应的方程式为___ 。
(4)3-乙基吡啶有多种同分异构体,其中含苯环的同分异构体有____ 种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式为____ 。
 )是一种重要的有机合成中间体,具有芳香性。回答下列问题:
)是一种重要的有机合成中间体,具有芳香性。回答下列问题:(1)3-乙基吡啶中所含元素电负性由大到小的顺序为
(2)3-乙基吡的沸点高于2,6-二甲基吡啶(
 ),分析可能的原因为
),分析可能的原因为(3)吡啶(
 )的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与
)的键合情况和苯类似,所以与苯有类似的性质,既能发生加成反应,又能发生取代反应;其中发生取代反应时,N间位碳原子上的氢原子要比邻位和对位活泼。1mol3-乙基吡啶最多能与(4)3-乙基吡啶有多种同分异构体,其中含苯环的同分异构体有
您最近一年使用:0次
名校
解题方法
3 . 学习化学一定要领悟好问题情景。
(1)①书写以下各微粒的电子式。
—OH___________ ,HBrO___________ ,CS2___________ ,NH4H___________ ;
②用电子式表示Na和S形成Na2S的过程___________ 。
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=___________ kJ·mol-1。
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因___________ 。
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:
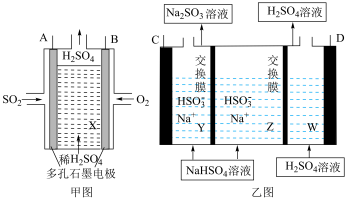
①甲图中A电极上的反应式为___________ 。
②甲图中B与乙图___________ (填“C”或“D”)极相连,进行电解时乙图Z中Na+向___________ (填“Y”或“W”)中移动。
③该电解池阴极的电极反应式为___________ ;
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
(1)①书写以下各微粒的电子式。
—OH
②用电子式表示Na和S形成Na2S的过程
(2)氮元素的化合物种类繁多,性质也各不相同。请回答下列问题:
已知:①N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
③N2(g)+3H2(g)=2NH3(g)ΔH=-92.4kJ·mol-1
则反应:④4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的ΔH=
(3)电负性与原子所处的具体的化学环境紧密相关。有机化合物CH3I和CF3I发生水解时的主要反应分别是:CH3I+H2O→CH3OH+HI和CF₃I+H₂O→CF3H+HIO。从电负性的角度分析,为什么CF3I水解的产物不是HI的原因
(4)工业上用Na2SO3吸收尾气中SO2使之转化为NaHSO3,再以SO2为原料设计原电池,然后电解(惰性电极)NaHSO3制取H2SO4,装置如下:

①甲图中A电极上的反应式为
②甲图中B与乙图
③该电解池阴极的电极反应式为
(5)Ni可活化C2H6放出CH4,其反应历程如下图所示:

下列关于活化历程的说法错误的是
| A.活化能最大的步骤:中间体2→中间体3 |
| B.只涉及极性键的断裂和生成 |
| C.在此反应过程中Ni的成键数目发生变化 |
D.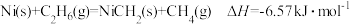 |
您最近一年使用:0次
4 . Robert O。Ritchie团队在Science杂志发表论文,报道了一种由铬、钴和镍组成的三元高熵合金(CrCoNi),这种金属材料不但具有极高的延展性和强度,而且其低温(20K)断裂韧性更打破了迄今为止的记录。下列叙述正确的是
| A.CrCoNi的熔点高于Ni的熔点 |
| B.上述三种金属元素都位于元素周期表d区 |
| C.上述合金的机械强度低于组成合金的金属 |
| D.上述金属的基态原子中,未成对电子数最多的是Ni |
您最近一年使用:0次
2023-08-31更新
|
81次组卷
|
4卷引用:河北省保定市部分高中2023-2024学年高三上学期开学考试化学试题
解题方法
5 . 下列关于配合物 的说法中正确的是
的说法中正确的是
 的说法中正确的是
的说法中正确的是A.在 中, 中, 给出孤电子对, 给出孤电子对, 提供空轨道 提供空轨道 |
B. 组成元素中电负性最大的元素是氮元素 组成元素中电负性最大的元素是氮元素 |
| C.阴离子的空间结构是平面正方形 |
D. 的空间构型为正四面体形 的空间构型为正四面体形 |
您最近一年使用:0次
6 . 物质的结构决定其性质。下列实例与解释不相符的是
| 选项 | 实例 | 解释 |
| A | O3在CCl4中的溶解度大于在水中的溶解度 | O3的极性微弱 |
| B | 冰的密度小于水 | 冰中的氢键具有方向性和饱和性,降低了水分子的空间利用率 |
| C | CF3COOH的酸性强于CCl3COOH | F的电负性比Cl大 |
| D | 12一冠醚一4识别Li+ | 超分子具有自组装的特征 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 . Al及其化合物在生产生活中有广泛应用。
回答下列问题:
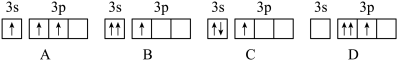
(1)运-20的外壳使用了铝合金:Mg-Al-Mn,下列选项中能表示基态Al原子价层电子排布图的是______ 。(填选项字母);第一电离能:铝______ (填“大于”“等于”或“小于”)镁。
(2)三乙基铝是一种金属有机物,可做火箭燃料,其结构简式为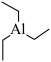 。
。
①三乙基铝熔点为-52.5℃,其晶体类型为______ 。
②三乙基铝中Al的VSEPR模型为______ ,C原子的杂化方式为______ 。
③三乙基铝中所含元素的电负性从大到小的顺序为______ (用元素符号表示)。
(3)工业上冶炼铝时需加入助熔剂冰晶石(Na3AlF6),[AlF6]3-中的中心原子的配位数为______ 。
(4)AlP晶胞结构与Si的类似,如图所示:
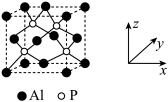
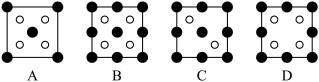
①磷化铝晶胞沿着x轴的投影图为______ (填选项字母)。
②若磷化铝的晶胞边长为a pm,NA表示阿伏加德罗常数的值,则AlP晶体密度为______ g/cm3(用含NA、a的最简代数式表示)。
回答下列问题:
(1)运-20的外壳使用了铝合金:Mg-Al-Mn,下列选项中能表示基态Al原子价层电子排布图的是

(2)三乙基铝是一种金属有机物,可做火箭燃料,其结构简式为
 。
。①三乙基铝熔点为-52.5℃,其晶体类型为
②三乙基铝中Al的VSEPR模型为
③三乙基铝中所含元素的电负性从大到小的顺序为
(3)工业上冶炼铝时需加入助熔剂冰晶石(Na3AlF6),[AlF6]3-中的中心原子的配位数为
(4)AlP晶胞结构与Si的类似,如图所示:

①磷化铝晶胞沿着x轴的投影图为

②若磷化铝的晶胞边长为a pm,NA表示阿伏加德罗常数的值,则AlP晶体密度为
您最近一年使用:0次
2022-12-24更新
|
145次组卷
|
2卷引用:河北省衡水市2022-2023学年高三上学期12月份大联考化学试卷
8 . 氟化钠主要应用在涂装工业中做磷化促进剂、农业杀虫剂、防腐剂等各个领域。下列说法中正确的是
A.离子半径大小关系: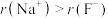 |
B.实验室盛放 溶液或 溶液或 溶液,可以用带玻璃塞的试剂瓶保存 溶液,可以用带玻璃塞的试剂瓶保存 |
| C.一般来说,同族元素从上到下元素电负性逐渐变小,第VIIA族中氟的电负性最大 |
D.基态钠原子中,其电子占据的最高能层的符号是 |
您最近一年使用:0次
名校
解题方法
9 . 元素周期表有许多有趣的编排方式,一种元素周期表的一部分如图所示,0、I~VIII均代表族序数,A~I代表不同的元素。
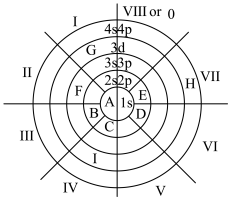
回答下列问题:
(1)H所代表的元素为_____ (填元素符号),I元素在周期表中的位置是_____ ,基态I原子的外围电子排布式为_____ 。
(2)图示周期表所列的元素中,电负性最大的元素是_____ (填元素符号,下同);B、C、D、E的第一电离能从大到小的顺序为_____ 。
(3)F、G分别与D形成的化合物中均含的键是_____ (填“离子键”或“共价键”),均属于_____ 晶体。
(4)利用图示周期表中所列元素,完成表格:(中心原子X上没有孤电子对,所用元素均为图中元素)

回答下列问题:
(1)H所代表的元素为
(2)图示周期表所列的元素中,电负性最大的元素是
(3)F、G分别与D形成的化合物中均含的键是
(4)利用图示周期表中所列元素,完成表格:(中心原子X上没有孤电子对,所用元素均为图中元素)
| XYn | 分子的空间结构 | 典型例子(填化学式) |
| n=2 | ① | ② |
| n=3 | ③ | ④ |
| n=4 | ⑤ | ⑥ |
您最近一年使用:0次
解题方法
10 . 氟代硼铍酸钾晶体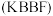 是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:
是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:
(1)基态K原子核外电子排布式为___________ ,在该原子中,原子轨道能量: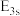
___________ (填“>”或“<”,下同)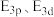
___________ 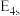 。
。
(2)上述四种元素中,第一电离能最小的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)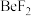 的空间构型为
的空间构型为___________ , 的杂化类型为
的杂化类型为___________ , 的键角比
的键角比 的键角
的键角___________ (填“大”或“小”),用价层电子对互斥理论解释原因为___________ 。
(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:
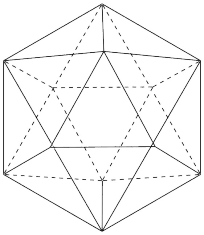
①晶体硼属于___________ 晶体,其理由是___________ 。
②每一个硼基本单元由___________ 个原子组成。
(5)已知 晶体具有
晶体具有 型结构,在
型结构,在 测出
测出 晶体密度为
晶体密度为 。
。 晶胞边长为
晶胞边长为___________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
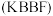 是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:
是一种非线性光学晶体材料,能够将激光转化为史无前例的176纳米波长(深紫外)激光,从而可以制造出深紫外固体激光器。回答下列问题:(1)基态K原子核外电子排布式为
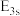
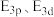
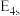 。
。(2)上述四种元素中,第一电离能最小的是
(3)
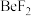 的空间构型为
的空间构型为 的杂化类型为
的杂化类型为 的键角比
的键角比 的键角
的键角(4)已知晶体硼的熔、沸点及硬度数据和基本结构单元(由硼原子组成的正二十面体如图所示,每个三角形均为正三角形,每个顶点为一个硼原子)如下:
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
| 熔点(K) | 3832 | 1683 | 2573 |
| 沸点(K) | 5100 | 2628 | 3823 |
| 硬度 | 10 | 7.0 | 9.6 |

①晶体硼属于
②每一个硼基本单元由
(5)已知
 晶体具有
晶体具有 型结构,在
型结构,在 测出
测出 晶体密度为
晶体密度为 。
。 晶胞边长为
晶胞边长为 (阿伏加德罗常数用
(阿伏加德罗常数用 表示)。
表示)。
您最近一年使用:0次



