名校
1 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+离子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素基态原子的电子排布式为________ 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为________ (填元素符号),其原因是________________________________________________________________________ 。
(3)D元素与氟元素相比,电负性:D________ (填“>”“=”或“<”)F,下列表述中能证明这一事实的是______ (填选项序号)。
A.常温下氟气的颜色比D单质的颜色深 B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态 D.比较两元素的单质与氢气化合时得电子的数目
(4)由A、C两元素可形成化合物CA5含有的化学键类型为________ 。
(5)B2A4是重要的石油化工原料,B2A4的结构式为________ 。B2A4通过聚合反应可以生成一种有机高分子化合物,反应方程式为________ 。
(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深 B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态 D.比较两元素的单质与氢气化合时得电子的数目
(4)由A、C两元素可形成化合物CA5含有的化学键类型为
(5)B2A4是重要的石油化工原料,B2A4的结构式为
您最近一年使用:0次
2 . A、B、C、D、E、F、G、W是原子序数依次增大的8种元素,A元素原子的2p轨道上有2个未成对电子;B元素在同周期中原子半径最大,与A可形成原子个数比为1∶1和2∶1的两种化合物;C的单质是一种常见的半导体材料;F有9个原子轨道,且只有一个未成对电子,没有空轨道;G的单质是一种常见金属,其 价离子
价离子 有4个未成对电子;W能形成红色(或砖红色)的
有4个未成对电子;W能形成红色(或砖红色)的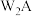 和黑色的WA两种化合物。请回答下列问题:
和黑色的WA两种化合物。请回答下列问题:
(1)C原子最高能级的电子云轮廓图是___________ 形状,W位于元素周期表___________ 区,W的简化电子排布式为___________ 。
(2)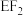 中中心原子的杂化轨道类型为
中中心原子的杂化轨道类型为___________ , 的VSEPR模型为
的VSEPR模型为___________ 。
(3)D、E、F三种元素第一电离能从大到小的顺序是___________ (用元素符号及“>”表示)。
(4)A、B、C、D四种元素电负性由大到小顺序是___________ (用元素符号及“>”表示)。
(5) 比
比 稳定,原因是
稳定,原因是___________ 。
 价离子
价离子 有4个未成对电子;W能形成红色(或砖红色)的
有4个未成对电子;W能形成红色(或砖红色)的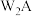 和黑色的WA两种化合物。请回答下列问题:
和黑色的WA两种化合物。请回答下列问题:(1)C原子最高能级的电子云轮廓图是
(2)
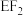 中中心原子的杂化轨道类型为
中中心原子的杂化轨道类型为 的VSEPR模型为
的VSEPR模型为(3)D、E、F三种元素第一电离能从大到小的顺序是
(4)A、B、C、D四种元素电负性由大到小顺序是
(5)
 比
比 稳定,原因是
稳定,原因是
您最近一年使用:0次
3 . 钒和镍及其化合物是重要的合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的价电子排布式为_______ ,其排布时能量最高的电子所占据能级的原子轨道有_______ 个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属元素的电负性由大到小的顺序为
中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______ 。与CN-互为等电子体的一种分子的化学式为________ 。
(4) 三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF5、H2O2等为主要原料来制取。
①H2O2分子中O 原子的杂化方式为_______ 。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为_______ 。
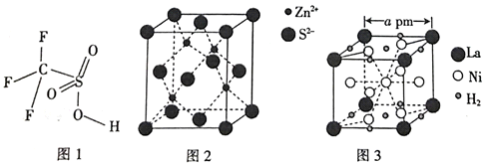
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2 所示,该晶胞中S2-的配位数为_________ 。
(6)镧镍合金是重要的储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为_________ 。
②该镧镍合金储氢后氢的密度为_________ (用NA表示阿伏伽德罗常数的数值)g/cm3。
(1)基态钒原子的价电子排布式为
(2)VO2+与
 可形成配合物。
可形成配合物。 中,三种非金属元素的电负性由大到小的顺序为
中,三种非金属元素的电负性由大到小的顺序为(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为
(4) 三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF5、H2O2等为主要原料来制取。
①H2O2分子中O 原子的杂化方式为
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为

(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2 所示,该晶胞中S2-的配位数为
(6)镧镍合金是重要的储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为
②该镧镍合金储氢后氢的密度为
您最近一年使用:0次



