1 . 邻二氮菲能与Fe2+发生显色反应,生成橙红色螯合物,用于Fe2+检验,化学反应如下。下列说法正确的是
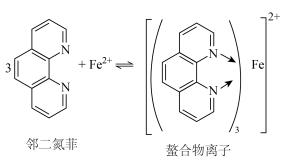
| A.邻二氮菲的核磁共振氢谱有6组吸收峰 |
| B.元素的电负性顺序:N>H>C>Fe |
| C.每个螯合物离子中含有2个配位键 |
| D.用邻二氮菲检验Fe2+时,需要调节合适的酸碱性环境 |
您最近一年使用:0次
2024-03-22更新
|
1428次组卷
|
6卷引用:河北省承德市部分高中2024届高三下学期二模化学试题
河北省承德市部分高中2024届高三下学期二模化学试题东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷(已下线)题型5 物质结构与性质 有机物的结构与性质(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)化学(辽宁卷01)-2024年高考押题预测卷天津市滨海新区2024届高三下学期高考三模化学试卷湖北省沙市中学2024届高三下学期模拟预测化学试题
解题方法
2 .  有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
(1)基态Co原子的价层电子排布图为______ ;金属Co的熔点、沸点均高于金属K的原因为______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为______ ;C、N、O、F的第一电离能由大到小的顺序为______ 。
(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
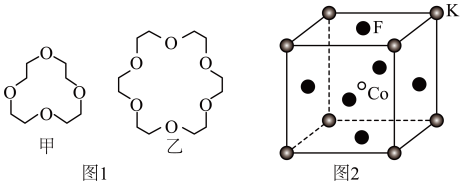
①冠醚中O原子的杂化形式为______ ;H、C、O的电负性由小到大的顺序为______ 。
② 不能镶入甲中而易镶入乙中的原因为
不能镶入甲中而易镶入乙中的原因为______ 。
(4) 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
①每个晶胞中由K和F共同形成的正四面体空隙有______ 个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于______ 位置。
③若晶胞参数为a pm,阿伏加德罗常数的值为 ,晶体密度ρ=
,晶体密度ρ=______  。
。
 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:(1)基态Co原子的价层电子排布图为
(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。

①冠醚中O原子的杂化形式为
②
 不能镶入甲中而易镶入乙中的原因为
不能镶入甲中而易镶入乙中的原因为(4)
 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。①每个晶胞中由K和F共同形成的正四面体空隙有
②晶胞的另一种表示中,Co处于各顶角位置,则K处于
③若晶胞参数为a pm,阿伏加德罗常数的值为
 ,晶体密度ρ=
,晶体密度ρ= 。
。
您最近一年使用:0次
2021-04-10更新
|
474次组卷
|
4卷引用:河北省承德市2021届高三下学期第二次模拟考试化学试题
河北省承德市2021届高三下学期第二次模拟考试化学试题河北省张家口市2021届高三第二次模拟考试化学试题(已下线)2021年高考化学押题预测卷(河北卷)(01)(含考试版、答题卡、参考答案、全解全析)(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)
解题方法
3 . 下列物质结构或性质比较中,前者大于后者的是
A.熔点: | B.键角: 中 中 、 、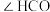 |
C.酸性: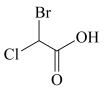 、 、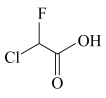 | D.沸点: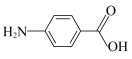 、 、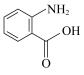 |
您最近一年使用:0次
2023-07-14更新
|
62次组卷
|
2卷引用:河北省承德市2022-2023学年高二下学期期末考试化学试题
名校
解题方法
4 . 镧系为元素周期表中第ⅢB族、原子序数为57〜71的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________ .
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________ 。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____ 填元素名称)。
几种镧系元素的电离能(单位:kJ∙mol-1)
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______ (用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________ (任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____ ,分子中所含化学键类型有 _______ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____ 个氧原子;已知晶胞参数为apm,密度为ρg∙cm-3,NA=_______ (用含a、ρ的代数式表示)。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是
几种镧系元素的电离能(单位:kJ∙mol-1)
| 元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
| Yb (镱) | 604 | 1217 | 4494 | 5014 |
| Lu (镥) | 532 | 1390 | 4111 | 4987 |
| La (镧) | 538 | 1067 | 1850 | 5419 |
| Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为
②画出氨的最简单气态氢化物水溶液中存在的氢键:
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有
您最近一年使用:0次
2019-12-01更新
|
313次组卷
|
8卷引用:河北省承德市各县第一中学2018届高三上学期期末考试化学试题
5 . O、S、Cl、Fe、Cu、五种元素的单质及其化合物在工农业生产和生活中有着广泛的应用。请回答下列问题:
(1)Fe元素有_______ 种不同运动状态的电子,基态Fe原子价电子的轨道表示式为_______ 。
(2)O、S、Cl的电负性由大到小的顺序是_______ (填元素符号)。
(3)O、S的最简单氢化物中键角较大的是_______ (填化学式),原因是_______ 。
(4) 的空间结构为
的空间结构为_______ 。
(5)O、Cu组成的一种化合物的晶胞结构示意图如下。
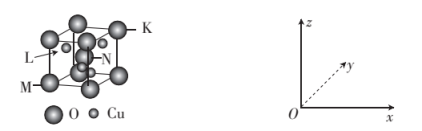
①该化合物的化学式为_______ 。
②原子坐标参数表示了晶胞内部各微粒的相对位置。若原子M、N、K的原子坐标参数分别为(0,0,0)、( ,
, ,
, )、(1,1,1),则L坐标参数为
)、(1,1,1),则L坐标参数为_______ 。
③晶胞边长:描述晶胞的大小和形状。若晶胞边长为anm,设NA为阿伏加德罗常数的值,该化合物的密度为_______ (用含a、NA的代数式表示) 。
。
(1)Fe元素有
(2)O、S、Cl的电负性由大到小的顺序是
(3)O、S的最简单氢化物中键角较大的是
(4)
 的空间结构为
的空间结构为(5)O、Cu组成的一种化合物的晶胞结构示意图如下。
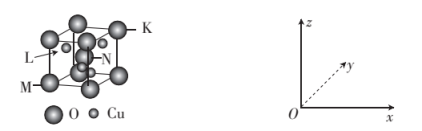
①该化合物的化学式为
②原子坐标参数表示了晶胞内部各微粒的相对位置。若原子M、N、K的原子坐标参数分别为(0,0,0)、(
 ,
, ,
, )、(1,1,1),则L坐标参数为
)、(1,1,1),则L坐标参数为③晶胞边长:描述晶胞的大小和形状。若晶胞边长为anm,设NA为阿伏加德罗常数的值,该化合物的密度为
 。
。
您最近一年使用:0次
6 . TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2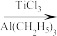
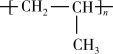
TiO2+2C+2Cl2 TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg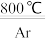 Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________ 。
(2)丙烯分子中,碳原子轨道杂化类型为______ 和____ 。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________ 。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________ 。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______ 。
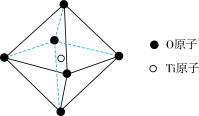
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________ 。
nCH3CH=CH2
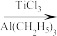
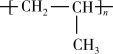
TiO2+2C+2Cl2
 TiCl4+2CO
TiCl4+2COTiCl4+2Mg
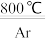 Ti+2MgCl2
Ti+2MgCl2(1)Ti3+的基态核外电子排布式为
(2)丙烯分子中,碳原子轨道杂化类型为
(3)Mg、Al、Cl第一电离能由大到小的顺序是
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为

(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为
您最近一年使用:0次
2019-12-17更新
|
114次组卷
|
2卷引用:河北省承德第一中学2020届高三上学期第三次月考化学试题
名校
7 . 二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。

回答下列问题:
(1)锌基态离子的价电子排布图为_______________ ;在基态18O原子中,核外电子存在_________ 种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________ ;1mol 碳酸乙烯酯中含有的σ键的数目为__________ NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________ (填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________ 。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________ 。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________ ;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______ g·cm-3(用NA表示阿伏伽德罗常数的值,列出算式不要求结果)。

回答下列问题:
(1)锌基态离子的价电子排布图为
(2)乙二醇中C、H、O的电负性大小关系是
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为
您最近一年使用:0次
2018-01-15更新
|
257次组卷
|
2卷引用:河北省承德一中2019届高三上学期第二次月考(期中)化学试题



