名校
解题方法
1 . 硒化锌是一种重要的半导体材料;其晶胞结构如图甲所示,已知晶胞参数为pnm,乙图为晶胞的俯视图,下列说法正确的是
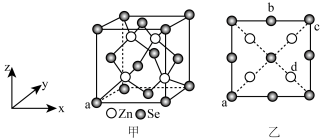
| A.晶胞中硒原子的配位数为12 |
B.晶胞中d点原子分数坐标为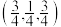 |
C.相邻两个Zn原子的最短距离为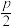 nm nm |
| D.电负性:Zn>Se |
您最近一年使用:0次
2023-03-03更新
|
1854次组卷
|
10卷引用:河北省张家口市宣化第一中学2023届高三模拟试题(三)化学试题
河北省张家口市宣化第一中学2023届高三模拟试题(三)化学试题山东省济宁市2023届高三一模考试(3月)化学试题山东省德州市第一中学2022-2023学年高二下学期3月月考化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题11-15)河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题(已下线)专题十 晶胞示意图(练)福建省龙岩市连城县第一中学2022-2023学年高二下学期5月月考化学试题河南省驻马店市环际大联考2022-2023学年高二下学期4月期中考试化学试题(已下线)热点08 金属晶体和离子晶体山东省烟台市第一中学2023-2024学年高三下学期3月月考化学试题
2 . “律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,它由Q、W、X、Y、Z五种原子序数依次增大的元素组成。该五种元素的性质或结构信息如下表:
下列说法正确的是
| 元素 | 信息 |
| Q | 基态原子只有一种形状的轨道填有电子,并容易形成共价键 |
| W | 基态原子有5个原子轨道填充有电子,有2个未成对电子 |
| X | 最高价氧化物对应的水化物与Y、Z最高价氧化物对应的水化物都能反应 |
| Y | 在元素周期表中位于第3周期、第ⅥA族 |
| Z | 焰色反应为紫色 |
| A.电负性:Q<W<Y | B.第一电离能:W<X<Z |
| C.简单离子半径:X<W<Z<Y | D.这种物质只含离子键 |
您最近一年使用:0次
2022-11-02更新
|
1042次组卷
|
6卷引用:河北省张家口市张北县第一中学2022-2023学年高二下学期4月月考化学试题
3 . 甲基氯硅烷(CH3SiH2Cl)、乙二胺(NH2CH2CH2NH2)和乙二醇(HOCH2CH2OH)常用于制备硅橡胶和聚合物树脂。下列说法错误的是
| A.上述物质中硅和氮的杂化方式相同 |
| B.上述物质所含元素中,电负性的大小顺序为O>N>C>Si |
| C.乙二胺中氢键(N-H…N)的键能高于乙二醇中氢键(O-H…O)的键能 |
| D.上述物质所含元素中,第一电离能的大小顺序为N>O>C>Si |
您最近一年使用:0次
2024-03-27更新
|
252次组卷
|
2卷引用:2024届河北省张家口市高三下学期一模化学试题
4 . 世界卫生组织公布镍金属和镍合金是致癌物。请结合所学知识完成问题:
(1)镍原子在周期表中的位置_______ ,其电子排布式为_______ 。
(2) 溶液与丁二酮肟的反应如下图,该反应可以用来鉴别
溶液与丁二酮肟的反应如下图,该反应可以用来鉴别 。
。
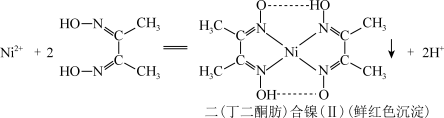
①丁二酮肟中同周期元素的第一电离能由大到小的顺序为_______ 。
②二(丁二酮肟)合镍(Ⅱ)中存在的化学键类型有_______ (填标号)。
A.极性键 B.非极性键 C.氢键 D.配位键
(3)可以用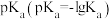 来衡量酸的强弱。下表是部分酸的
来衡量酸的强弱。下表是部分酸的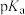 数据:
数据:
从表中数据可知,酸性: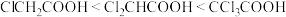 ,请从物质结构角度解释原因
,请从物质结构角度解释原因_______ 。
(4)某种镁、镍和碳三种元素形成的晶体具有超导性。该晶体可看作是镁原子位于顶点,镍原子位于面心的面心立方堆积(晶胞结构如图,未标出碳原子位置),碳原子只填充在由镍构成的八面体空隙。
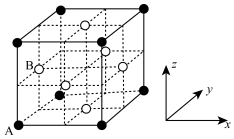
①填充在八面体空隙的碳原子位于该晶胞的_______ 位置。
②原子的分数坐标:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,若A点原子分数坐标 ,B点原子分数坐标
,B点原子分数坐标 ,则碳原子的分数坐标为
,则碳原子的分数坐标为_______ 。
③已知晶胞中相邻且最近的镁、碳原子间核间距为 ,
, 为阿伏加德罗常数的值,其密度为
为阿伏加德罗常数的值,其密度为_______  (列出计算式即可)。
(列出计算式即可)。
(1)镍原子在周期表中的位置
(2)
 溶液与丁二酮肟的反应如下图,该反应可以用来鉴别
溶液与丁二酮肟的反应如下图,该反应可以用来鉴别 。
。
①丁二酮肟中同周期元素的第一电离能由大到小的顺序为
②二(丁二酮肟)合镍(Ⅱ)中存在的化学键类型有
A.极性键 B.非极性键 C.氢键 D.配位键
(3)可以用
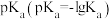 来衡量酸的强弱。下表是部分酸的
来衡量酸的强弱。下表是部分酸的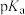 数据:
数据:| 物质 |  |  |  |
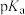 (室温) (室温) | 2.86 | 1.29 | 0.65 |
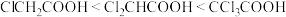 ,请从物质结构角度解释原因
,请从物质结构角度解释原因(4)某种镁、镍和碳三种元素形成的晶体具有超导性。该晶体可看作是镁原子位于顶点,镍原子位于面心的面心立方堆积(晶胞结构如图,未标出碳原子位置),碳原子只填充在由镍构成的八面体空隙。

①填充在八面体空隙的碳原子位于该晶胞的
②原子的分数坐标:以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,若A点原子分数坐标
 ,B点原子分数坐标
,B点原子分数坐标 ,则碳原子的分数坐标为
,则碳原子的分数坐标为③已知晶胞中相邻且最近的镁、碳原子间核间距为
 ,
, 为阿伏加德罗常数的值,其密度为
为阿伏加德罗常数的值,其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
5 . 短周期主族元素W、X、Y、Z的原子序数依次增大,其中X、Y、Z同周期,X原子的电子数等于Y原子的最外层电子数。W、X、Y形成的分子的结构如图所示。下列说法正确的是


| A.电负性:W<X<Y<Z |
| B.W、Y、Z可形成离子晶体 |
| C.Y与Z形成的化合物均可被强碱溶液吸收 |
| D.W分别与Y、Z形成简单化合物的沸点:Y>Z |
您最近一年使用:0次
名校
6 . 以下有关元素性质的说法正确的是
A.①  ,K,Rb ② ,K,Rb ②  ,P,As ③O,S,Se ④ ,P,As ③O,S,Se ④  ,P,Cl, 元素的电负性依次递增的是④ ,P,Cl, 元素的电负性依次递增的是④ |
| B.某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,该元素一定在第三周期第IIA族 |
C.下列原子中,①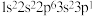 ② ② 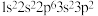 ③ ③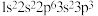 ④ ④ 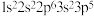 对应的第一电离能最大的是④ 对应的第一电离能最大的是④ |
D.以下原子中,①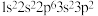 ② ② 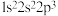 ③ ③ 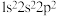 ④ ④ 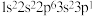 半径最大的是① 半径最大的是① |
您最近一年使用:0次
2021-09-11更新
|
562次组卷
|
6卷引用:河北省张家口市第一中学2020-2021学年高二下学期期中考试(衔接班)化学试题
名校
解题方法
7 . 回答问题
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了Al、Cr、Cu、C、N、O、Si等多种元素。上述元素中基态原子未成对电子数与Al相同的有___________ 。
(2)元素铋主要用于制造易熔金属合金,元素Bi位于第6周期VA族,其基态原子的价电子排布式为___________ 。Bi(NO3)3∙5H2O中各元素电负性从大到小的顺序为___________ 。
(3)N、P、As均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
①下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是___________ (填序号,下同),未成对电子最多的是___________ 。
a. 1s22s22p3 b. 1s22s2 c. 1s22s12p4 d. 1s2s12p3
②Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是___________ ,第一电离能由大到小的顺序是___________ 。
(1)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了Al、Cr、Cu、C、N、O、Si等多种元素。上述元素中基态原子未成对电子数与Al相同的有
(2)元素铋主要用于制造易熔金属合金,元素Bi位于第6周期VA族,其基态原子的价电子排布式为
(3)N、P、As均为氮族元素,这些元素与人们的生活息息相关。回答下列问题:
①下列状态的N原子或离子在跃迁时,用光谱仪可捕捉到发射光谱的是
a. 1s22s22p3 b. 1s22s2 c. 1s22s12p4 d. 1s2s12p3
②Si、P与S是同周期中相邻的元素,Si、P、S的电负性由大到小的顺序是
您最近一年使用:0次
解题方法
8 .  有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
(1)基态Co原子的价层电子排布图为______ ;金属Co的熔点、沸点均高于金属K的原因为______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为______ ;C、N、O、F的第一电离能由大到小的顺序为______ 。
(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
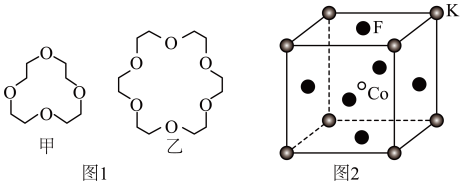
①冠醚中O原子的杂化形式为______ ;H、C、O的电负性由小到大的顺序为______ 。
② 不能镶入甲中而易镶入乙中的原因为
不能镶入甲中而易镶入乙中的原因为______ 。
(4) 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
①每个晶胞中由K和F共同形成的正四面体空隙有______ 个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于______ 位置。
③若晶胞参数为a pm,阿伏加德罗常数的值为 ,晶体密度ρ=
,晶体密度ρ=______  。
。
 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:(1)基态Co原子的价层电子排布图为
(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。

①冠醚中O原子的杂化形式为
②
 不能镶入甲中而易镶入乙中的原因为
不能镶入甲中而易镶入乙中的原因为(4)
 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。①每个晶胞中由K和F共同形成的正四面体空隙有
②晶胞的另一种表示中,Co处于各顶角位置,则K处于
③若晶胞参数为a pm,阿伏加德罗常数的值为
 ,晶体密度ρ=
,晶体密度ρ= 。
。
您最近一年使用:0次
2021-04-10更新
|
474次组卷
|
4卷引用:河北省张家口市2021届高三第二次模拟考试化学试题
河北省张家口市2021届高三第二次模拟考试化学试题河北省承德市2021届高三下学期第二次模拟考试化学试题(已下线)2021年高考化学押题预测卷(河北卷)(01)(含考试版、答题卡、参考答案、全解全析)(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)
名校
9 . 下列比较中,正确的是
| A.第一电离能:Na<Mg<Al | B.电负性:Cl>S>As |
| C.原子半径:O>F>Na | D.最高正化合价:F>S>N |
您最近一年使用:0次
2024-03-01更新
|
148次组卷
|
3卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高二下学期开学收心联考化学试题
名校
10 . 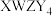 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是
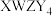 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是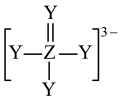
| A.电负性:Y>Z>X | B.W能与Y的简单氢化物反应生成 |
C.该化合物中Z采用 杂化 杂化 | D.Y元素形成的单质一定为非极性分子 |
您最近一年使用:0次
2024-05-14更新
|
156次组卷
|
2卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高三下学期4月模拟测试化学试题



