名校
解题方法
1 . 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 三氟乙酸酸性强于三氯乙酸 | F原子电负性大于Cl原子,吸电子能力强 |
| B | 常温下,铜与稀硫酸不反应,与稀硝酸反应 | 硝酸酸性强于硫酸 |
| C | 常温下溶解度: 大于 大于 |  水解程度大于 水解程度大于 |
| D |  、 、 混合气体通入 混合气体通入 溶液中产生的白色沉淀是 溶液中产生的白色沉淀是 | 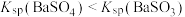 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列说法正确的是
| A.同一周期的元素中,第VIIA族元素的第一电离能最大 |
| B.中心原子是sp杂化的分子,其空间结构不一定为直线形 |
| C.电负性大于1.8的元素一定为非金属元素,小于1.8的一定为金属元素 |
| D.基态Mg原子失去第一个电子吸收的能量大于失去第二个电子吸收的能量 |
您最近一年使用:0次
2022-02-22更新
|
292次组卷
|
4卷引用:河北省邢台市四校联考2021-2022学年高二下学期第二次月考化学试题
解题方法
3 . X、Y、Z、M是电负性逐渐减小的短周期非金属元素。X、Z、M位于三个不同周期,Y与Z的价电子数之和为M价电子数的两倍;化合物 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是
 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是| A.Y的含氧酸为弱酸 |
| B.Z与M形成的化合物具有较强的还原性 |
| C.简单氢化物的稳定性:X>Y>M |
| D.原子半径:Z<X<Y<M |
您最近一年使用:0次
4 . 一种无机纳米晶体材料,仅由铯、铅、溴三种元素构成,在太阳能电池方向有巨大应用前景。回答下列问题:
(1)基态 原子核外电子占据能量最高的能级的电子云轮廓图形状为
原子核外电子占据能量最高的能级的电子云轮廓图形状为_______ 。 属于
属于_______ 区元素。
(2)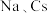 位于同主族,
位于同主族,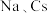 元素的第一电离能分别为
元素的第一电离能分别为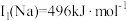 、
、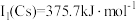 。
。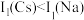 的原因是
的原因是_______ 。
(3) 三种元素的电负性如下表。
三种元素的电负性如下表。 具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是
具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是_______ 。
(4)该晶体材料的立方结构如图所示,其化学式为_______ 。若其晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度=
,则该晶体密度=_______  。
。
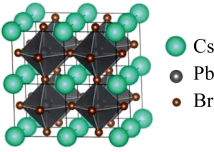
(5)该晶体材料电池并未实现商业化,原因在于自身的不稳定性。
①该晶体材料在潮湿环境中易从固体变成溶液(发生相变),导致器件效率降低,其原因是_______ 。
②某大学采用 对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,
对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,_______ (离子)脱离晶格,用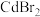 钝化后的晶体比原晶体材料更稳定,其原因是
钝化后的晶体比原晶体材料更稳定,其原因是_______ 。
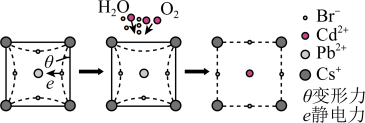
(已知:应力与应变相伴而生,从原子尺度上来理解,应力为单位晶格上的作用力,应变即为晶格的拉伸或收缩,对应于拉伸应变和压缩应变。对应出现的驰豫是指一个宏观平衡系统由于受到外界的作用变为非平衡状态,再从非平衡状态过渡到新的平衡态的过程。)
(1)基态
 原子核外电子占据能量最高的能级的电子云轮廓图形状为
原子核外电子占据能量最高的能级的电子云轮廓图形状为 属于
属于(2)
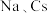 位于同主族,
位于同主族,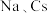 元素的第一电离能分别为
元素的第一电离能分别为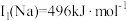 、
、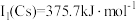 。
。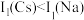 的原因是
的原因是(3)
 三种元素的电负性如下表。
三种元素的电负性如下表。 具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是
具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是| 电负性 | ||
| F | Br | Pb |
| 4.0 | 2.8 | 1.9 |
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度=
,则该晶体密度= 。
。
(5)该晶体材料电池并未实现商业化,原因在于自身的不稳定性。
①该晶体材料在潮湿环境中易从固体变成溶液(发生相变),导致器件效率降低,其原因是
②某大学采用
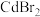 对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,
对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,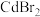 钝化后的晶体比原晶体材料更稳定,其原因是
钝化后的晶体比原晶体材料更稳定,其原因是
(已知:应力与应变相伴而生,从原子尺度上来理解,应力为单位晶格上的作用力,应变即为晶格的拉伸或收缩,对应于拉伸应变和压缩应变。对应出现的驰豫是指一个宏观平衡系统由于受到外界的作用变为非平衡状态,再从非平衡状态过渡到新的平衡态的过程。)
您最近一年使用:0次
解题方法
5 . 我国科学家及其合作团队研究发现,六方相(hep)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:
(1)基态铁原子最外层电子所在能级的电子云轮廓图为_______ 形。
(2)H、C、O三种元素的电负性由大到小的排序为_______ (填元素符号)。
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
请解释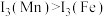 的主要原因:
的主要原因:_______ 。
(4)H、C、O三种元素可以组成很多种物质。
① 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有_______ (填化学式)。
②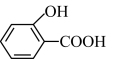 的沸点
的沸点_______ (填“大于”、“小于”或“等于”)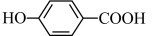 的沸点。
的沸点。
(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
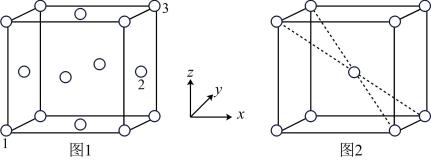
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为_______ 。
②若图2中晶胞参数为apm,则该晶胞的空间利用率(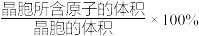 )为
)为_______ (用含π的式子表示)%。
(1)基态铁原子最外层电子所在能级的电子云轮廓图为
(2)H、C、O三种元素的电负性由大到小的排序为
(3)锰和铁处于同一周期,锰、铁电离能数据如表所示:
| 元素 | 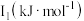 |  | 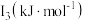 |
| Mn | 717.3 | 1509.9 | 3248 |
| Fe | 762.5 | 1561.9 | 2953 |
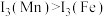 的主要原因:
的主要原因:(4)H、C、O三种元素可以组成很多种物质。
①
 、
、 、
、 、
、 、
、 中属于非极性分子的有
中属于非极性分子的有②
 的沸点
的沸点 的沸点。
的沸点。(5)用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。

①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为
②若图2中晶胞参数为apm,则该晶胞的空间利用率(
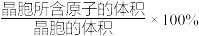 )为
)为
您最近一年使用:0次
2022-07-06更新
|
243次组卷
|
2卷引用:河北省邢台市2021-2022学年高二下学期期末考试化学试题
6 . KH2PO4晶体具有优异的非线性光学性能,关于该物质涉及的元素,下列说法正确的是
| A.电负性:P>O>H |
| B.离子半径大小:K+>P3->O2- |
| C.基态K原子有19种不同运动状态的电子 |
D.基态P原子的价层电子轨道表示式: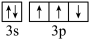 |
您最近一年使用:0次
2023-04-24更新
|
289次组卷
|
10卷引用:河北省邢台市2021-2022学年高二下学期期末考试化学试题
河北省邢台市2021-2022学年高二下学期期末考试化学试题广东省云浮市2021-2022学年高二下学期期末教学质量检测化学试题湖北省恩施州高中教育联盟2021-2022学年高二下学期期末考试化学试题湖南省衡阳市祁东县2021-2022学年高二下学期期末考试化学试题云南省昆明市五华区2023届高三教学质量摸底检测化学试题福建省漳州市第三中学2022-2023学年高二下学期3月质量检测化学试题湖北省宜城市第一中学、枣阳一中等六校2022-2023学年高二下学期期中考试化学试题广东省顺德市(李兆基中学、郑裕彤中学、华侨中学)等2022-2023学年高二下学期4月期中考试化学试题广东省汕尾市华大实验学校2022-2023学年高二下学期5月月考化学试题云南省大理白族自治州民族中学2023-2024学年高三上学期见面考理科综合化学试题
7 . 五种短周期主族元素X、Y、Z、R、W的原子序数依次增大,它们形成的化合物结构如图所示。X是元素周期表中原子半径最小的元素,Y、Z、R为同周期元素。下列说法错误的是
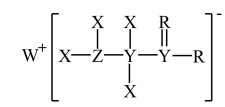
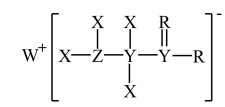
A.电负性: |
| B.仅由X、Z、R组成的化合物可能为离子化合物 |
| C.基态Y原子的s轨道的电子数与其p轨道的电子数相等 |
| D.W与R可形成两种离子化合物,两化合物中阴阳离子个数比相同 |
您最近一年使用:0次
2023-02-10更新
|
285次组卷
|
2卷引用:河北省邢台市2022-2023学年高三上学期期末考试化学试题
解题方法
8 . 我国科学家发现AgCrS2 (AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有___________ 个电子顺时针旋转。基态铬原子有___________ 个未成对电子。
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是___________ (填元素符号)。
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。 的空间构型为
的空间构型为___________ ,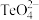 中碲的杂化类型是
中碲的杂化类型是___________ 。
③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是___________ 。
(3)配合物 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为___________ 。(Cr与O、N均形成了配位键)
(4)在银氨溶液中,1 mol 中含
中含___________ molσ键。
(5)复合材料氧铬酸钙的立方晶胞如图所示。
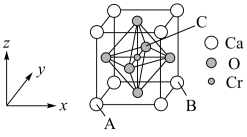
①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为___________ 。
②1个钙原子与___________ 个氧原子等距离且最近。
③该晶体密度为___________  (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。基态硫原子核外最多有
(2)氧族元素有氧、硫、硒(Se)、碲(Te)等元素。
①这四种元素中,电负性最大的是
②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。
 的空间构型为
的空间构型为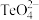 中碲的杂化类型是
中碲的杂化类型是③H2O、H2S、H2Se、H2Te的键角依次减小,其主要原因可能是
(3)配合物
 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为(4)在银氨溶液中,1 mol
 中含
中含(5)复合材料氧铬酸钙的立方晶胞如图所示。

①已知A、B的原子坐标分别为(0,0,0)、(1,1,0),则C的原子坐标为
②1个钙原子与
③该晶体密度为
 (列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
(列出计算式即可)。已知钙和氧的最近距离为a nm,NA代表阿伏加德罗常数。
您最近一年使用:0次
2021-12-03更新
|
559次组卷
|
3卷引用:河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三12月联考化学试题
河北省邢台市“五岳联盟”部分重点学校2021-2022学年高三12月联考化学试题河南省新乡市2021-2022学年高三上学期第一次模拟考试理综化学试题 (已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
解题方法
9 . M(结构如图)常用作农药中间体、橡胶助剂、合成树脂添加剂以及分析试剂等。X、Y、Z、W为短周期原子序数依次增大的主族元素,其中基态X原子内的电子只有1个运动状态,Y、Z位于X的下一周期,基态W原子s和p能级电子数之比为3:5。下列说法正确的是

| A.元素电负性:W>Z>Y | B.元素第一电离能:Y>Z>W |
| C.M分子中Y原子的孤电子对数为0 | D.M分子中σ键和π键数目之比为4:1 |
您最近一年使用:0次
2024-03-23更新
|
145次组卷
|
2卷引用:河北省邢台市名校质检联盟2023-2024学年高二上学期12月月考化学试题
名校
解题方法
10 . 近年来我国航天事业成果显著,其制造材料中包含了铝、镁、锌、钛、锰、铜、镍、铬、硅、氮、氧等多种元素。回答下列问题:
(1)铬元素属于周期表中_______ 区的元素,其基态原子核外电子空间运动状态有_______ 种,
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为_______ ,其中配位原子的电负性由小到大的顺序是_______ (写元素符号),[Ti(NH3)6]Cl3中∠H-N-H_______ (填“大于”、“小于”或“等于”)单个氨气分子中∠H-N-H,原因是_______ 。
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______ 。
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为_______ ,其配位数为_______ 。已知晶胞参数为a pm,设阿伏加德罗常数的值为NA,晶胞密度
_______  。(列出计算式即可)
。(列出计算式即可)

(1)铬元素属于周期表中
(2)钛能形成多种配合物,如Ti(CO)6、[Ti(H2O)6]Cl3、[Ti(NH3)6]Cl3等。其配合物的配位数均为
(3)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为

 。(列出计算式即可)
。(列出计算式即可) 
您最近一年使用:0次



