解题方法
1 . 硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________ 。
(2)根据元素周期律,电负性S______ Se,第一电离能Se______ As(填“>”或“<”)。
(3)H2O的沸点______________ (填“>”或“<”)H2Se的沸点,其原因是:______ 。
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为____ ,若晶胞参数为a pm,阿伏伽德罗常数的值用NA表示,若晶体密度为_______ g·cm﹣3。(列出表达式)。
(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于_______ 。若已知铜的原子半径为rcm,表示原子空间占有率的表达式为__________ 。
(1)锌离子的电子排布式是
(2)根据元素周期律,电负性S
(3)H2O的沸点
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为
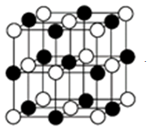
(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于
您最近一年使用:0次
2 . 下表是前20号元素中的部分元素的一些数据:
试回答下列问题:
(1)以上10种元素电负性最大的是_____ (填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____ 周期,第_____ 族,其基态原子的核外电子排布式是________ 。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________ 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________ 个σ键,________ 个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________ ;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________ ,其中X与Cu2+之间以_____________ 键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________ 。
b._________________________________ 。

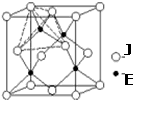
(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________ ,若晶胞边长为a cm,则晶体的密度为_______________ (用含a、NA的代数式表示)(g/mL)。
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
(1)以上10种元素电负性最大的是
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成
(4)I与氢元素形成的10电子分子X的空间构型为
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a.
b.

(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为

您最近一年使用:0次
2017-12-20更新
|
310次组卷
|
3卷引用:2020届高三化学二轮选修大题必练—— 物质结构与性质大题练
名校
解题方法
3 . 不能说明X的电负性比Y的大的是
| A.与H2化合时X单质比Y单质容易 |
| B.X单质可以把Y从其氢化物中置换出来 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
您最近一年使用:0次
2017-12-06更新
|
162次组卷
|
2卷引用:福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题
4 . 下表为周期表的一部分,其中的字母代表对应的元素,请针对这些元素回答下列问题.
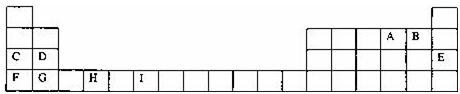
请回答下列问题:
(1)元素I的元素符号 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)表中元素第一电离能最小的是 (填元素符号,下同),电负性最大的是 ,化学性质最稳定的是 .
(3)表中元素处于d区的是 (填元素符号).
(4)请举出F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .

请回答下列问题:
(1)元素I的元素符号 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)表中元素第一电离能最小的是 (填元素符号,下同),电负性最大的是 ,化学性质最稳定的是 .
(3)表中元素处于d区的是 (填元素符号).
(4)请举出F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .
您最近一年使用:0次
2016-12-09更新
|
181次组卷
|
2卷引用:2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷
名校
解题方法
5 . 元素化学性质随着原子序数的递增呈现周期性变化的原因是
| A.原子半径的周期性变化 |
| B.电负性的周期性变化 |
| C.第一电离能的周期性变化 |
| D.原子核外电子排布的周期性变化 |
您最近一年使用:0次
2016-12-09更新
|
172次组卷
|
3卷引用:2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷
名校
6 . 下列说法正确的是( )
| A.Na、Mg、Al的第一电离能逐渐增大 |
| B.V、Cr、Mn的最外层电子数逐渐增大 |
| C.S2﹣、Cl﹣、K+的半径逐渐减小 |
| D.O、F、Ne的电负性逐渐增大 |
您最近一年使用:0次
2016-06-01更新
|
243次组卷
|
10卷引用:2015-2016学年福建省厦门市高二上学期期末质检化学试卷
2015-2016学年福建省厦门市高二上学期期末质检化学试卷【全国百强校】福建省厦门市外国语学校2018-2019学年高二(理)上学期期中考试化学试题福建省厦门外国语学校2018-2019学年高二下学期期中考试化学试题2015-2016学年吉林省扶余一中高二下学期期中考试化学试卷2017届河南信阳高考化学暑假自学自测专练:原子结构与性质广东省实验中学2016-2017学年高二下学期期中考试化学试题四川省邻水实验学校2019-2020学年高二下学期阶段检测化学试卷云南省玉溪市新平彝族傣自治县第一中学2020-2021学年高三上学期开学考试化学试题湖北省南漳县第二中学2021-2022学年高二下学期3月月考化学试题安徽省 淮北师范大学附属实验中学2022-2023学年高二下学期第一次月考化学试题



