名校
1 . 短周期元素X、Y、Z、W、R的原子序数依次增大,Y与W同主族,Z与R同主族,它们形成的甲、乙两种物质(如图)是有机合成中常用的还原剂。下列说法正确的是
甲: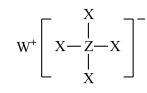 ,乙:
,乙: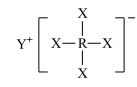
甲:
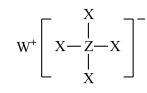 ,乙:
,乙: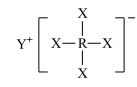
| A.电负性:X>Z>R |
| B.第一电离能:Y<Z<R |
| C.元素Z和R最高价氧化物对应的水化物都具有两性 |
| D.单质Y和W在空气中燃烧的产物所含化学键类型完全相同 |
您最近一年使用:0次
2022-03-03更新
|
723次组卷
|
6卷引用:福建省福安市第一中学2023届高三上学期第一次检测化学试题
福建省福安市第一中学2023届高三上学期第一次检测化学试题福建省福清虞阳中学2023-2024学年高三上学期第一次综合训练化学试题山东省淄博市2022届高三下学期第一次模拟考试化学试题广东省佛山市第四中学2021-2022学年高二下学期3月段考化学试题(已下线)专项08 物质结构 元素周期律-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)云南省富源县第一中学2021-2022学年高三下学期4月月考化学试题
名校
2 . 短周期元素W、X、Y、Z的原子序数依次增大,其中基态W原子的s能级电子总数是p能级电子总数的2倍,Y与W同主族,X的最简单氢化物的水溶液呈碱性,基态Z原子的核外电子中只有一个未成对电子。下列说法错误的是
| A.电负性:Z>W>Y | B.最简单氢化物的沸点:X>W>Y |
| C.原子半径:Y>W>X | D.Z的单质具有强氧化性 |
您最近一年使用:0次
名校
解题方法
3 . 下列对有关事实的原因分析错误的是
| 事实 | 原因 | |
| A | 白磷(P4)为正四面体分子 | 白磷分子中P−P键间的夹角是109°28′ |
| B | 分子内不同化学键之间存在一定的夹角 | 共价键具有方向性 |
| C | 键的极性H−O键>H−S键 | O的电负性大于S的电负性 |
| D | 通常状况下,1体积水溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-24更新
|
1069次组卷
|
9卷引用:福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题
福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题山东省烟台市2021-2022学年高二上学期期末考试化学试题(已下线)第二章 分子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖北省新高考联考协作体2021-2022学年高二3月考试化学试题山东省枣庄市第三中学2021-2022学年高二3月质量检测化学试题广东省佛山市顺德区第一中学 2021-2022学年高二下学期期中考试化学试题山东省沂南第一中学2021-2022学年高二4月月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省深圳市盐田高级中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
4 . 根据元素性质递变规律,下列判断不正确的是
| A.酸性:H2SiO3 < H3PO4 < H2SO4 | B.电负性:F > Cl > Br > I |
| C.第一电离能:Na < Mg < Al | D.原子半径:N > O > F |
您最近一年使用:0次
2021-12-03更新
|
206次组卷
|
3卷引用:福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题
福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
解题方法
5 . 下列有关微拉性质的比较中,正确的是
A.原子半径: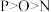 | B.最高正价: |
C.第一电离能: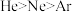 | D.电负性: |
您最近一年使用:0次
2021-09-22更新
|
465次组卷
|
5卷引用:福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题
福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题(已下线)第1章 原子结构与性质(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)陕西省宝鸡市金台区2021-2022学年高二下学期期中考试化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷
名校
解题方法
6 . 回答下列问题:
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
②Co2+的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是___________ 。
(4)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为___________ 。
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为___________ (用含a和ρ的最简代数式表示)
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为
②Co2+的最高能层电子排布式为
③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为
 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是(4)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为
您最近一年使用:0次
7 . 科学工作者合成了含镁、镍、碳3种元素的超导材料,具有良好的应用前景,回答下列问题:
(1)镍元素位于周期表第_______ 列,基态镍原子d轨道中成对电子与单电子的数量比为_______ 。
(2)在CO分子中,C与O之间形成_______ 个σ键、_______ 个π键,在这些化学键中,O原子共提供了_______ 个电子。
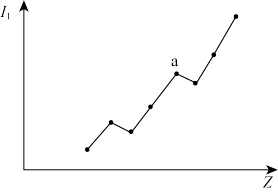
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是_______ 。原子核对外层电子的引力增大,导致I1在a点出现齿峰的原因是_______ 。
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是_______ 。
②NH3、PH3、AsH3中沸点最高的是_______ ,其主要原因是_______ 。
(1)镍元素位于周期表第
(2)在CO分子中,C与O之间形成
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是
②NH3、PH3、AsH3中沸点最高的是

您最近一年使用:0次
2021-05-11更新
|
128次组卷
|
2卷引用:福建省泉州一中2020-2021学年高三上学期期末化学试题
8 . 二氟化二氧(O2F2)是一种极强的氧化剂和氟化剂,可以发生反应:H2S+4O2F2=SF6+2HF+4O2。下列有关说法不正确的是
| A.还原性:H2S>HF |
| B.离子半径:S2->O2->F- |
| C.上述反应中被还原的元素的基态原子的成对电子个数为4 |
D.上述反应的四种元素中电负性最强的元素的基态原子价层电子排布图为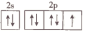 |
您最近一年使用:0次
2021-03-17更新
|
311次组卷
|
4卷引用:福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题
名校
解题方法
9 . 我国科学家团队采用自激发缺陷诱导的方法获得白光,合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2。
(1)基态50Sn原子的价电子排布式为______ 。Ba、Sn、O三种元素的电负性由大到小的顺序为______ 。
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为______ ;硼砂中存在的作用力有______ (填标号)。
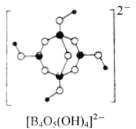
a.氢键 b.离子键 c.共价键 d.配位键
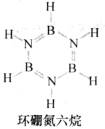
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是______ 。
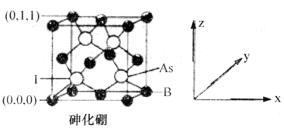
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3。(列出含a、NA的计算式即可)。
(1)基态50Sn原子的价电子排布式为
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为

a.氢键 b.离子键 c.共价键 d.配位键
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是

(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
2021-02-04更新
|
274次组卷
|
2卷引用:福建省厦门双十中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
10 . 磷化铜(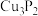 )用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的
)用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的 ,下列判断错误的是
,下列判断错误的是
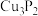 )用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的
)用于制造磷青铜,磷青铜是含少量金属锡、磷的铜合金,主要用作耐磨零件和弹性原件,磷化铜与水作用产生有毒的 ,下列判断错误的是
,下列判断错误的是A. 中心原子的杂化方式为 中心原子的杂化方式为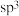 |
| B.电负性:Cu<P |
C.熔沸点: > > |
D.基态Cu原子的价电子轨道表示式为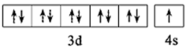 |
您最近一年使用:0次
2021-02-02更新
|
365次组卷
|
4卷引用:福建省莆田第二十五中学2023-2024学年高二下学期期中考试化学试题



