1 . 现有两种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
| A.未成对电子数:①>② | B.原子半径大小:①>② |
| C.电负性大小:②>① | D.第一电离能大小:②>① |
您最近一年使用:0次
2021-01-29更新
|
206次组卷
|
3卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
解题方法
2 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: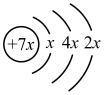 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(3)D的氢化物比C的氢化物的沸点高,原因____________________ 。
(4)E元素在周期表的第_______ 周期,第________ 族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区。
(5)B、C最高价氧化物的晶体类型是分别是______ 晶体、______ 晶体
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(3)D的氢化物比C的氢化物的沸点高,原因
(4)E元素在周期表的第
(5)B、C最高价氧化物的晶体类型是分别是
您最近一年使用:0次
10-11高二下·江西南昌·期末
3 . 以下有关元素性质的说法不正确的是( )
| A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是① |
| B.下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的电负性随原子序数增大而递增的是④ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
您最近一年使用:0次
2020-08-21更新
|
1226次组卷
|
37卷引用:福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题
福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题(已下线)2010-2011学年江西省新建二中高二下学期期末考试化学试卷(已下线)2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷2015-2016学年辽宁省沈阳二中高二下期中化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期中考试化学试题山西省怀仁县第一中学2016-2017学年高二下学期第三次(5月)月考化学试题河南省洛阳名校2017-2018学年高二上学期第二次联考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题吉林省白山市第七中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月16日 《每日一题》选修3-每周一测甘肃省临泽一中2018-2019学年高二下学期期末模拟化学试题(已下线)2019年11月22日 《每日一题》2020年高考化学一轮复习——电离能和电负性江苏省南京师范大学苏州实验学校2019-2020学年高二上学期期中考试化学试题(已下线)专题11.3 晶体结构与性质(练)-《2020年高考一轮复习讲练测》辽宁省实验中学东戴河分校2019-2020学年高二12月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择基础专练】第1章 原子结构——B拓展区综合拓展(鲁科版选修3)甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)辽宁省大连市大连海湾高级中学2019-2020学年高二下学期第一次质量检测化学试题山东省潍坊昌乐县第二中学2020届高三上学期期末化学模拟试题二(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 综合检测卷鲁科版2019选择性必修2第1章综合检测卷高二选择性必修2(人教版2019)第一章 原子结构与性质 第二节综合训练(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)河南省开封市五县2020-2021学年高二下学期月考化学试题四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题安徽省六安第一中学2021-2022学年高二上学期期末考试化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律四川省绵阳中学2022-2023学年高二上学期第一次月考化学试题河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题山东省青岛一中2023-2024学年高一下学期4月月考化学试卷新疆乌鲁木齐市第三十一中学2023-2024学年高二下学期3月月考 化学试题
4 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
 溶液对应的pH(25℃) 溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性:Z<W | B.简单离子半径:W<Y |
| C.元素第一电离能:Z<W | D.简单氢化物的沸点:X<Z |
您最近一年使用:0次
2020-07-11更新
|
8518次组卷
|
45卷引用:福建省福州第一中学2021-2022学年高二下学期期中考试化学试题
福建省福州第一中学2021-2022学年高二下学期期中考试化学试题2020年天津卷化学高考试题(已下线)专题06 物质结构 元素周期律-2020年高考真题和模拟题化学分项汇编(已下线)第8单元 原子结构 元素周期律(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)小题必刷22 元素周期表(律)及其应用——2021年高考化学一轮复习小题必刷(通用版)(人教版2019)选择性必修2 第一章 原子结构与性质 章末综合检测卷(已下线)热点6 物质结构与元素周期律-2021年高考化学专练【热点·重点·难点】(新高考)(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)专题04 物质结构和元素周期律——备战2021年高考化学纠错笔记(已下线)解密05 物质结构元素周期律(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题湖北省沙市第五中学2020-2021学年高二下学期3月月考化学试题(已下线)小题15 元素周期表、律(根据物质性质角度的元素推断)——备战2021年高考化学经典小题考前必刷(全国通用)山东省济南大学城实验高级中学2021届高三4月阶段性测试化学试题河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点07 元素周期律和元素周期表-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第36讲 原子结构与性质(精练)-2022年一轮复习讲练测(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题04 物质结构与元素周期律—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)2020年天津卷化学高考真题变式题1-12湖北省沙市中学2021-2022学年高二上学期期末考试化学试题广东省云浮市云安区云安中学2021-2022学年高二下学期第一次统测化学试题(已下线)考点07 元素周期律和元素周期表-备战2023年高考化学一轮复习考点帮(全国通用)专题1~2 综合检测(提升卷)(已下线)第14讲 元素周期律和元素周期表(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第29讲 原子结构与性质(讲)-2023年高考化学一轮复习讲练测(新教材新高考)北京市第八十中学2022-2023学年高三上学期期末测试化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型80 用表格承载信息考查元素周期律(已下线)第五章 物质结构与性质元素周期律 第27练 元素周期表和元素周期律北京市第八十中学2023届高三下学期二模适应考试化学试题(已下线)专题07 元素周期表与元素周期律(已下线)第2讲 元素素周期表 元素周期律天津市耀华中学2023-2024学年度高三上学期开学检测化学试题天津市红桥区2023-2024学年高三上学期期中考试化学试题河北省保定市唐县第一中学2023-2024学年高二上学期12月期中考试化学试题河南省南阳市第一中学校2023-2024学年高二上学期12月月考化学试题北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题云南省保山市腾冲市第八中学2024届高三上学期期末模拟考试化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题北京市第十四中学2023-2024学年高三下学期三模化学试题
名校
解题方法
5 . 我国科研人员发现了一种新型超导体 ,由
,由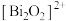 和
和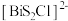 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是
 ,由
,由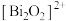 和
和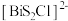 交替堆叠构成。已知
交替堆叠构成。已知 位于第六周期VA族,下列有关说法错误的是
位于第六周期VA族,下列有关说法错误的是A. 的价电子排布式为 的价电子排布式为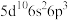 |
B.有关元素的电负性: |
C. 属于含共价键的离子化合物 属于含共价键的离子化合物 |
| D.该新型超导体的组成元素全部位于元素周期表p区 |
您最近一年使用:0次
2020-05-12更新
|
839次组卷
|
17卷引用:福建省泉州实验中学2021届高三3月测试(二)化学试题
福建省泉州实验中学2021届高三3月测试(二)化学试题山东省青岛市2020届高三4月统一质量检测(一模)化学试题山东省烟台市中英文学校2021届高三上学期期末考试化学试题(已下线)2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)山东省潍坊第四中学2022届高三上学期第一次过程检测化学试题河北省石家庄市第二十三中学2021-2022学年高二下学期期中考试化学试题专题1~2 综合检测(提升卷)第二节综合拔高练山西省临汾市尧都区山西师范大学实验中学2021-2022学年高二下学期第一次月考化学考试试题山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题山东省济宁市育才中学2022-2023学年高二上学期第二次学情检测化学试题广东省深圳市盐田高级中学2021-2022学年高二下学期4月考试化学试题广东省潮阳一中、宝安中学等七校联考2022-2023学年高三上学期第二次(11月)联考化学试题吉林省松原市前郭尔罗斯蒙古族自治县第五高级中学(前郭五中)2023-2024学年高三上学期第三次考试 化学试卷 河南省郑州市宇华实验学校2023-2024学年高三上学期1月期末化学试题新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高二下学期第一次月考化学试卷河南省郑州市宇华实验学校2023-2024学年高二下学期5月月考化学试题
名校
解题方法
6 . 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
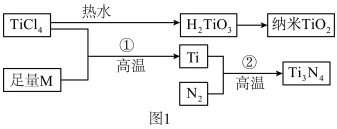
图中的M是短周期金属元素,M的部分电离能如表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为________________ 。
(2)M是________ (填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为____ 。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有________ 个,化合物乙中采取sp3方式杂化的原子3对应的元素的电负性由大到小的顺序为________________ 。
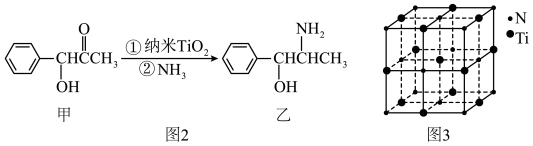
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________________ g/cm3 (NA为阿伏加 德罗常数的值,只列计算式)。该晶体中与氮原子距离相等且最近的氮原子有________ 个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为__________________ 。

图中的M是短周期金属元素,M的部分电离能如表:
I1 | I2 | I3 | I4 | I5 | |
| 电离能/(kJ/mol) | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为
(2)M是
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。化合物甲的分子中采取sp2方式杂化的碳原子有

(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ/mol) | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为
您最近一年使用:0次
2020-03-30更新
|
297次组卷
|
7卷引用:2016届福建省漳州八校高三下学期第三次联考理科综合化学试卷
名校
解题方法
7 . 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________ ,As基态原子核外有__________ 个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________ ,Ga、As、Se的电负性由大到小的顺序是__________________ 。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________ ,GaF的熔点超过1000℃,可能的原因是__________________________ 。
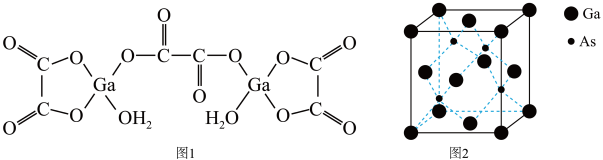
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________ ,草酸根离子中碳原子的杂化轨道类型为__________ 。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________ g·cm-3(设NA为阿伏加 德罗常数的值,列出计算式即可)。
(1)Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
| 镓的卤化物 | CaCl3 | CaBr3 | CaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为

您最近一年使用:0次
2020-02-11更新
|
240次组卷
|
6卷引用:福建省莆田市第九中学2019届高三上学期第一次调研考试理科综合化学试题
名校
解题方法
8 . 现有四种元素的基态原子的电子排布式如下: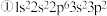 ;
; 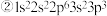 ;
; 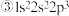 ;
;  则下列有关比较中正确的是
则下列有关比较中正确的是
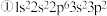 ;
; 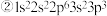 ;
; 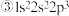 ;
;  则下列有关比较中正确的是
则下列有关比较中正确的是A.电负性: | B.原子半径: |
C.第一电离能: | D.最高正化合价: |
您最近一年使用:0次
2019-12-22更新
|
431次组卷
|
8卷引用:福建省福州第一中学2021-2022学年高二下学期期中考试化学试题
福建省福州第一中学2021-2022学年高二下学期期中考试化学试题2016-2017学年四川省成都市九校高二下学期期中联考化学试卷2016-2017学年山东省淄博市高青一中、淄博实验中学高二下学期期中联考化学试卷【全国百强校】内蒙古北方重工业集团有限公司第三中学2017-2018学年高二下学期期末考试化学试题湖北省黄冈市浠水实验高中2019—2020学年高二上学期12月月考化学试题山西省实验中学2019-2020学年高二下学期第一次月考化学试题(已下线)专题13 原子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题
名校
解题方法
9 . GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________ ;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________ (填标号)。
A.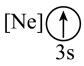 B.
B.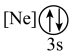 C.
C.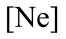 D.
D.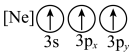
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________ ; 8—羟基喹啉合铝中所含元素电负性最大的是______________ (填元素符号,下同),第一电离能最大的是__________ (填元素符号),N原子的杂化方式为_____________ 。
(3)已知下列化合物的熔点:
①表格中卤化物的熔点产生差异的原因是_______________________________________________ 。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________ ;其中Al的配位数为_________ 。
(1)基态As原子核外电子排布式为[Ar]
A.
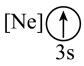 B.
B.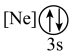 C.
C.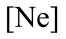 D.
D.
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与
 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为(3)已知下列化合物的熔点:
| 化合物 | AlF3 | GaF3 | AlCl3 |
| 熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为
您最近一年使用:0次
2019-12-18更新
|
222次组卷
|
2卷引用:福建省南安第一中学2020届高三上学期第二次月考化学试题
名校
解题方法
10 . 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Ga 基态原子核外电子排布式为_______ ,As 基态原子核外有_______ 个未成对电子。
(2)Ga、As、Se 的电负性由大到小的顺序是__________ 。
(3)GaCl3和AsF3的立体构型分别是____________ ,__________ 。
(4)比较下列镓的卤化物的熔点和沸点,分析其变化的原因:____________ 。
GaF3的熔点超过1000 ℃,可能的原因是_____ 。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。[B(OH)4]-中B原子的杂化类型为______ 。
(6)若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅,若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________ (用化学式表示);
(1)Ga 基态原子核外电子排布式为
(2)Ga、As、Se 的电负性由大到小的顺序是
(3)GaCl3和AsF3的立体构型分别是
(4)比较下列镓的卤化物的熔点和沸点,分析其变化的原因:
| 镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000 ℃,可能的原因是
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。[B(OH)4]-中B原子的杂化类型为
(6)若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅,若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
您最近一年使用:0次



