名校
1 . 下列有关说法错误的是
A. 与氢气反应生成 与氢气反应生成 时,碳的杂化方式发生变化 时,碳的杂化方式发生变化 |
B.赤血盐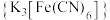 中电负性最大的是 中电负性最大的是 |
C.金刚石的晶胞为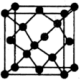 ,其俯视图为 ,其俯视图为 |
D.因为第一电离能: ,故酸性: ,故酸性: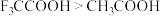 |
您最近一年使用:0次
名校
解题方法
2 . 以物质的量之比3:1的Fe和Al共熔后结晶得Fe3Al晶体,晶胞结构如图一所示,该晶胞为立方晶胞,晶胞参数为a pm。血红素(如图二)是血红蛋白的活性部位,其中心元素是Fe( II)。二者是常见的含铁物质,请回答下列问题。
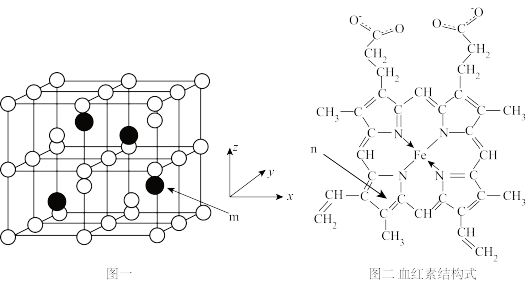
(1)Fe2+的价电子排布式为:_______ 。
(2)血红素分子中非金属元素电负性由大到小的顺序是_______ (用元素符号表示);这些元素形成的简单氢化物中沸点由高到低的顺序是_______ (用化学式表示);C、N、O三种元素形成一种阴离子CNO-,其结构中有_______ 个σ键,_______ 个π键。
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为_______ ;该环_______ (填“有”、“无”)芳香性。
(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为_______ (以含π的代数式表示)。
(5)m原子的原子分数坐标为_______ . ;晶胞内任意两个A1原子之间的距离为_______ pm。
(6)Fe3Al晶体的密度为_______ g·cm-3。

(1)Fe2+的价电子排布式为:
(2)血红素分子中非金属元素电负性由大到小的顺序是
(3)有机分子中的闭环平面结构中,成环原子的π电子数等于4n+2(n=1,2,3
 )时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为
)时,该环具有芳香性。n环为血红素中含N最小环,且为平面结构,则N杂化类型为(4)Fe3Al晶胞中,rA1=b pm, rFe=c pm,则该晶胞的空间利用率为
(5)m原子的原子分数坐标为
(6)Fe3Al晶体的密度为
您最近一年使用:0次
2022-04-29更新
|
627次组卷
|
3卷引用:江西省九江市2021届高三三模考试化学试题
3 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________ ;金属离子与氧离子间的作用力为__________ ,Ca2+的配位数是__________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是__________ ;若晶胞参数为a nm,则晶体密度为_________ g·cm-3(列出计算式)。_______ 、_______ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是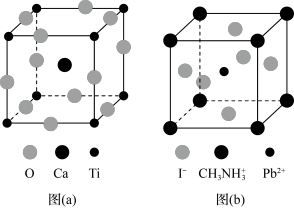
您最近一年使用:0次
2020-07-08更新
|
15371次组卷
|
21卷引用:江西省九江市2022届第二次高考模拟统一考试理综化学试题
江西省九江市2022届第二次高考模拟统一考试理综化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题北京一零一中学2021-2022学年高三上学期10月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅱ化学真题变式题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)贵州省罗甸县边阳中学2022届高三模拟测试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质四川省成都锦江区嘉祥外国语高级中学2023-2024学年高三下学期第一次诊断性考试理科综合试题-高中化学河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题重庆市万州第二高级中学2021-2022学年高二下学期6月第三次质量检测化学试题
名校
解题方法
4 . (NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O等铁的配合物用途非常广泛。回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______ 。
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____ 。
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____ 。
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(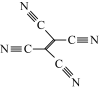 )。
)。
①CH3CN中碳原子的杂化方式是____ 和_____ 。
②TCNE中第一电离能较大的是___ (填元素符号),分子中所有原子____ (填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是 ___ 。
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为___ (列出计算式)g·cm-3。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为
(2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
(3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是
(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE(
 )。
)。①CH3CN中碳原子的杂化方式是
②TCNE中第一电离能较大的是
(5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如图所示:

Fe3C的密度为
您最近一年使用:0次
2020-04-06更新
|
618次组卷
|
4卷引用:江西省九江市十校2020届高三下学期模拟考试理综化学试题
江西省九江市十校2020届高三下学期模拟考试理综化学试题河南等省五岳2020届高三4月联考(全国I卷)理综化学试题河南省临颍县南街高级中学2020届高三下学期第一次月考理综化学试题(已下线)01 物质结构与性质综合题型集训(1) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)



