名校
解题方法
1 . 3-氨基-1-金刚烷醇可用于合成药物维格列汀(治疗2型糖尿病),其分子结构如下图所示。下列说法不正确的是

A.分子中O原子和N原子均为 杂化 杂化 | B.分子中的键角: |
C.电负性: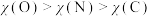 | D.第一电离能: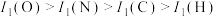 |
您最近一年使用:0次
2024-04-15更新
|
175次组卷
|
2卷引用:江西省新余市2023-2024学年高三上学期第一次调研考试化学试卷
名校
解题方法
2 . 五种短周期主族元素X、Y、Z、M、Q的原子序数依次增大,X的2p轨道半充满,Y的s能级电子数和p能级电子数相等, Z是至今发现的电负性最大的元素,M在元素周期表中处于周期序数等于族序数的位置,Q的单质被广泛用作半导体材料。下列叙述中不正确的是
| A.元素的第一电离能:X<Y<Z |
| B.气态氢化物的稳定性:X<Y<Z |
| C.气态氢化物分子的键角:Q>X>Y |
| D.最高价氧化物对应的水化物的酸性:X>Q>M |
您最近一年使用:0次
2023-05-11更新
|
942次组卷
|
8卷引用:江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题
江西省新余市第一中学2023-2024学年高三上学期开学考试化学试题湖北省名校2023届高三下学期5月适应性考试化学试题广东省汕头市金山中学2023屇高三下学期三模化学试题福建省泉州第五中学2023届高三一模化学试题吉林省辽源市田家炳高中友好学校七十六届期末联考2023-2024学年高三上学期1月期末化学试题(已下线)化学(天津卷03)-2024年高考化学押题预测卷(已下线)第06练 元素“位—构—性”的综合推断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)安徽省阜阳市第三中学2023-2024学年高二上学期1月期末化学试题
名校
3 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
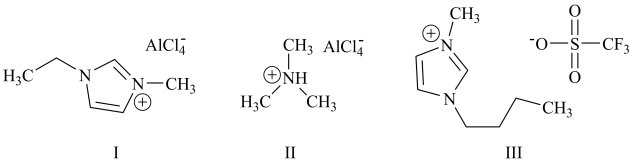
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.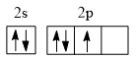 | B.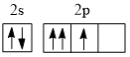 | C.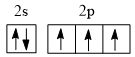 | D.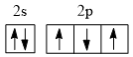 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
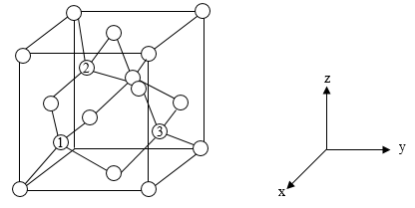
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2751次组卷
|
10卷引用:江西省新余市2022届高三第二次模拟考试理综化学试题
江西省新余市2022届高三第二次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
解题方法
4 . 铑的配合物Rh(PPh3)Cl可催化丙烯与氢气的加成,反应过程为:CH3CH=CH2+H2 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:
(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是_______ ,其原子中的未成对电子数为_______ 。
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为_______ ,其结构简式中打点的C原子与H原子间的σ键可称为sp2-sσ键,则丙烯分子中C原子之间的所有σ键可称为_______ 。
(3)第一电离能P_______ Cl (填“大于”或“小于”),PPh3是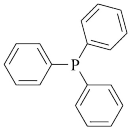 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是_______ 。比较PPh3与PH3的沸点大小,并说明原因_______ 。
(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):
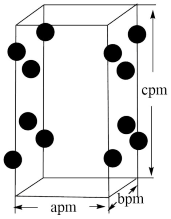
①晶胞中含有的Cl-数目为_______ ;
②若阿伏加德罗常数为NA,则晶体的密度为_______ g·cm-3.(列出计算式)
 CH3CH2CH3,回答下列问题:
CH3CH2CH3,回答下列问题:(1)基态Rh原子的价电子排布式为4d85s1,铑在周期表的位置是
(2) 1mol丙烯(CH3CH=CH2)中σ键的数目为
(3)第一电离能P
 的缩写,该分子的立体构型是
的缩写,该分子的立体构型是(4) RhCl3的晶胞结构中Rh3+的位置如图所示(Cl-未画出):

①晶胞中含有的Cl-数目为
②若阿伏加德罗常数为NA,则晶体的密度为
您最近一年使用:0次
2021-05-31更新
|
257次组卷
|
2卷引用:江西省新余市2023届高三下学期第二次模拟考试理科综合化学试题
5 . 利用铟(In)与锡(Sn)形成的金属间化合物InSn为基体,N(C2H5)3为催化剂,可将CO2与H2转化为HCOOH,反应的化学方程式为:CO2+H2 HCOOH。回答下列问题:
HCOOH。回答下列问题:
(1)In与Al为同族元素,其核外电子占据最高能层的符号为O,则In在元素周期表中的位置为___ 。基态In原子最高能级电子云轮廓图为____ 形。
(2)Sb为第ⅤA族从上到下的第四种元素,其价电子的轨道表示式为______ 。
(3)化学方程式中涉及的四种非金属元素电负性由小到大的顺序为_____ (用元素符号表示)。写出与CO2互为等电子体的一种阴离子____ (填离子符号)。
(4)催化剂N(C2H5)3分子中N原子的杂化方式为_____ ,其中碳原子成键电子对的空间构型为_____ 。
(5)HCOOH在水中溶解度远大于CO2的原因为____________ 。
(6)InSb晶体晶胞为立方晶胞(如图1),晶胞参数为631 pm,Sb位于顶点和面心,In位于Sb原子构成的四面体的体心。InSb晶体常用作金属锂的镶嵌材料,某种镶嵌锂之后的晶胞如图2,晶胞参数为664 pm(“ ”代表锂原子)。
”代表锂原子)。
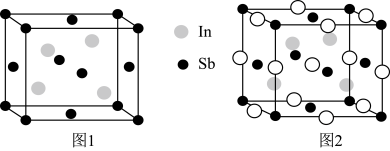
①图1所示晶胞中,距离最近的两个In原子间的距离为______ pm。(已知 ≈1.4)
≈1.4)
②图2所示晶胞的密度为______ g·cm−3。(列出计算式即可)
 HCOOH。回答下列问题:
HCOOH。回答下列问题: (1)In与Al为同族元素,其核外电子占据最高能层的符号为O,则In在元素周期表中的位置为
(2)Sb为第ⅤA族从上到下的第四种元素,其价电子的轨道表示式为
(3)化学方程式中涉及的四种非金属元素电负性由小到大的顺序为
(4)催化剂N(C2H5)3分子中N原子的杂化方式为
(5)HCOOH在水中溶解度远大于CO2的原因为
(6)InSb晶体晶胞为立方晶胞(如图1),晶胞参数为631 pm,Sb位于顶点和面心,In位于Sb原子构成的四面体的体心。InSb晶体常用作金属锂的镶嵌材料,某种镶嵌锂之后的晶胞如图2,晶胞参数为664 pm(“
 ”代表锂原子)。
”代表锂原子)。
①图1所示晶胞中,距离最近的两个In原子间的距离为
 ≈1.4)
≈1.4)②图2所示晶胞的密度为
您最近一年使用:0次
名校
解题方法
6 . 第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________ ,电子占据的最高能层的轨道形状为__________ 。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________ 。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________ (任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________ 。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________ 。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物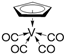 的熔点为138 ℃,其晶体类型为
的熔点为138 ℃,其晶体类型为__________ ;已知该化合物满足18电子规则,其配体“ ”中的大π键可表示为
”中的大π键可表示为__________ 。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。
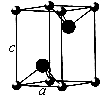
①VCl2和VBr2两者熔点差异的原因是__________ 。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________ (用含a、c、r+和r-的式子表示)。
(1)钒在周期表中的位置为
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、
②CO作配体时,配位原子是C而不是O,其原因是
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物
 的熔点为138 ℃,其晶体类型为
的熔点为138 ℃,其晶体类型为 ”中的大π键可表示为
”中的大π键可表示为(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为
您最近一年使用:0次
2018-05-29更新
|
792次组卷
|
5卷引用:【全国百强校】江西省新余市第四中学2020届高三第七次训练理科综合化学试题
【全国百强校】江西省新余市第四中学2020届高三第七次训练理科综合化学试题【全国百强校】四川省绵阳中学2018届高三考前适应性考试(三)理科综合化学试题四川省绵阳南山中学2020届高三下学期3月网络考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编解题达人.化学选择题(2021全国卷)精编特训10
名校
解题方法
7 . 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为______ 。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为______ 、______ 、______ ,推测盐中阴离子的空间构型为______ ,其中心原子杂化方式为______ 。
(3)Z、W两种元素电负性的大小关系为______ ;Y、Z两种元素第一电离能的大小关系为______ 。
(4)CO的结构可表示为C≡O,元素Y的单质Y2的结构也可表示为Y Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):
①结合数据说明CO比Y2活泼的原因:______ 。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是______ 。
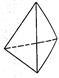
A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
(1)W原子的核外电子排布式为
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为
(3)Z、W两种元素电负性的大小关系为
(4)CO的结构可表示为C≡O,元素Y的单质Y2的结构也可表示为Y
 Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
①结合数据说明CO比Y2活泼的原因:
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是

A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
您最近一年使用:0次



