1 . 已知X、Y、Z、W为原子序数依次递增的主族元素,只有Y、Z同周期,W元素原子的4p轨道上有3个未成对电子,Y元素原子的2p轨道上有2个未成对电子,W与Y可形成化合物 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是| A.电负性:X>Y>Z |
| B.原子半径:W>Z>Y |
C. 的VSEPR模型和空间结构一致 的VSEPR模型和空间结构一致 |
| D.W元素的第一电离能高于同周期相邻元素的 |
您最近一年使用:0次
名校
解题方法
2 . 3-氨基-1-金刚烷醇可用于合成药物维格列汀(治疗2型糖尿病),其分子结构如下图所示。下列说法不正确的是

A.分子中O原子和N原子均为 杂化 杂化 | B.分子中的键角: |
C.电负性: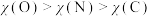 | D.第一电离能: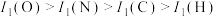 |
您最近一年使用:0次
2024-04-15更新
|
173次组卷
|
2卷引用:江西省新余市2023-2024学年高三上学期第一次调研考试化学试卷
解题方法
3 . 金属络合物是有机金属催化不对称反应中的一类重要的中间体,M为 (Ⅰ)的络合物单晶结构,如图所示。(
(Ⅰ)的络合物单晶结构,如图所示。( 为甲基,
为甲基, 为苯基)
为苯基)
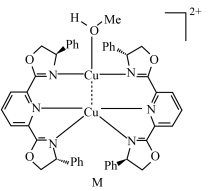
下列叙述正确的是
 (Ⅰ)的络合物单晶结构,如图所示。(
(Ⅰ)的络合物单晶结构,如图所示。( 为甲基,
为甲基, 为苯基)
为苯基)
下列叙述正确的是
A.第一电离能: | B.M中只有 与 与 (I)形成配位键 (I)形成配位键 |
C. 含 含 手性碳原子 手性碳原子 | D.M所含元素中,氮的电负性最大 |
您最近一年使用:0次
名校
解题方法
4 . 含有多个配位原子的配体与同一中心离子(或原子)通过整合配位成环而形成的配合物为整合物。一种Cd2+配合物的结构如图所示,下列说法不正确的是
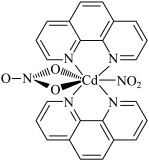
A.结构图右边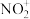 与O3互为等电子体 与O3互为等电子体 |
| B.N所形成的六元环中N的杂化方式为sp2 |
| C.该配合物分子中Cd2+的配位数为7 |
| D.图中所涉及元素的电负性由大到小顺序为:O>N>C>H>Cd |
您最近一年使用:0次
名校
5 . 现有四种元素的基态原子的电子排布式:①1s22s22p63s23p2 ②1s22s22p63s23p3③1s22s22p3 ④1s22s22p4。则下列有关比较正确的是
| A.原子半径:③>②>① | B.电负性:④>③>②>① |
| C.第一电离能:④>③>②>① | D.最高正化合价:④>③>②>① |
您最近一年使用:0次
2023-08-16更新
|
333次组卷
|
5卷引用:江西省抚州市黎川县第二中学2023-2024学年高三上学期开学考试化学试题
名校
6 . 2021年,我国科学家首次在实验室中用 等物质为原料经11步反应合成了淀粉,其中一步反应为
等物质为原料经11步反应合成了淀粉,其中一步反应为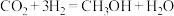 。下列说法正确的是
。下列说法正确的是
 等物质为原料经11步反应合成了淀粉,其中一步反应为
等物质为原料经11步反应合成了淀粉,其中一步反应为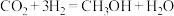 。下列说法正确的是
。下列说法正确的是| A.电负性:O>H>C |
B.键角: |
C.基态氧原子的价层电子排布图为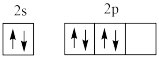 |
D.可与 形成分子间氢键 形成分子间氢键 |
您最近一年使用:0次
22-23高二下·江西宜春·阶段练习
7 . 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是
| A.X能与多种元素形成含有极性键的非极性分子 | B.简单氢化物沸点: |
C.第一电离能: | D.电负性: |
您最近一年使用:0次
名校
解题方法
8 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
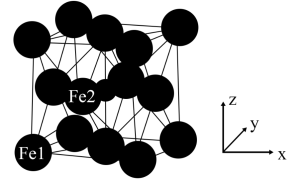
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
288次组卷
|
5卷引用:江西稳派2022-2023学年高三上学期期中联考化学试题
解题方法
9 . Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1) 的价电子排布图为:
的价电子排布图为:__ ;基态磷原子有___ 种空间运动状态不同的电子。
(2)Li、O、P三种元素的电负性由大到小的顺序是:__ 。
(3)写出一种与 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:__ ,该分子的中心原子的价层电子对数等于__ 。
(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:__ 。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是 分子中的键角大于
分子中的键角大于 分子中的键角,原因是:
分子中的键角,原因是:___ 。
(6) 为离子晶体,具有反萤石结构,晶胞如下图所示。则
为离子晶体,具有反萤石结构,晶胞如下图所示。则 配位数为:
配位数为:__ ,若晶胞参数为bnm,阿伏加德罗常数的值为 ,则
,则 的密度为
的密度为__  (列出计算式即可)。
(列出计算式即可)。

(1)
 的价电子排布图为:
的价电子排布图为:(2)Li、O、P三种元素的电负性由大到小的顺序是:
(3)写出一种与
 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)已知无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中不存在的微粒间作用力有:
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(5)N和P是同主族元素,但是
 分子中的键角大于
分子中的键角大于 分子中的键角,原因是:
分子中的键角,原因是:(6)
 为离子晶体,具有反萤石结构,晶胞如下图所示。则
为离子晶体,具有反萤石结构,晶胞如下图所示。则 配位数为:
配位数为: ,则
,则 的密度为
的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2021-04-06更新
|
483次组卷
|
2卷引用:江西省鹰潭市2021届高三一模理综化学试题
解题方法
10 . 太阳能电池板材料除单品硅外,还有铜、铟、稼、硒、硅等化学物质。
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se____ Si(填“>”、“<”)。人们把硅与氢元素形成的一类化合物叫硅烷(SinH2n+2)。硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是______________ 。
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是___________ 。
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为___________________ 。
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度_____ g/cm3。
(3)稼的基态原子的电子排布式是_______ 。与铟、稼元家处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物.如BF3能与NH3反应生成BF3·NH3。BF3·NH3中B原子的杂化轨道类型为______ ,B与N之间形成______ 键;硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质.其电离方程式为______________ 。
(1)硒、硅与氢元素形成的组成最简单的氢化物中,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
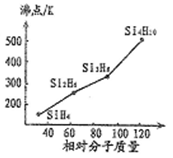
(2)①已知高温下CuO→Cu2O+O2,从铜原子价层电子结构(3d 和4s轨道上应填充的电子数)变化角度来看,能生成Cu2O的原因是
② 金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为
③ 铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,计算晶体铜的密度
(3)稼的基态原子的电子排布式是
您最近一年使用:0次



