名校
解题方法
1 . 图甲和图乙表示的是元素的某种性质随原子序数的变化。下列说法正确的是
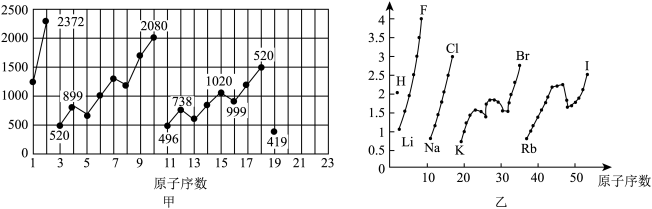
| A.图乙不可能表示元素的电负性随原子序数的变化关系 |
| B.图甲可能表示的是元素单质的熔点随原子序数的变化关系 |
| C.图乙可能表示的是元素原子的半径随原子序数的变化关系 |
| D.图甲可能表示的是元素原子的第一电离能随原子序数的变化关系 |
您最近一年使用:0次
2021-02-08更新
|
772次组卷
|
20卷引用:河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题
河北省邯郸市大名县第一中学2021-2022学年高二上学期第二次月考化学试题河北大名县第一中学2022-2023学年高二上学期12月份网上测试化学试题2014-2015福建省四地六校高二下学期第一次联考化学试卷2016-2017学年河南省郑州外国语学校高二下学期月考(一)化学试卷辽宁省朝阳市凌源市实验中学2019-2020学年高二下学期4月份月考化学试题广东省东莞市光明中学2021-2022学年高二上学期第一次月考化学试题福建省龙岩第一中学2021-2022学年高二下学期第一次月考化学试题重庆市朝阳中学2021-2022学年高二下学期第一次月考化学试题河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题山东省青岛一中2023-2024学年高一下学期4月月考化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期中考试化学试题福建省福清市华侨中学2018-2019学年高二年上学期期中考化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二下学期期中考试化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】山东省临沂市罗庄区2019-2020学年高二下学期期中考试化学试题(人教版2019)选择性必修2 第一章 原子结构与性质 综合检测卷鲁科版2019选择性必修2第1章综合检测卷陕西省西安市铁一中学2020-2021学年高二下学期期中考试化学试题第一章 本章达标检测2四川省眉山北外附属东坡外国语学校2023-2024学年高二下学期开学化学试题
名校
解题方法
2 . 著名的观赏石-崂山璐石主要成分可表示为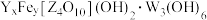 ,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
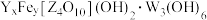 ,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是
,其中W、Y、Z表示三种原子序数依次增大的第三周期元素,W没有未成对电子,Z的最高正价与最低负价的代数和为0.下列说法错误的是| A.Y的离子半径在同周期元素中最小 |
| B.Z在它的简单氢化物中显负价 |
| C.W、Y、Z的最高价氧化物的水化物都属于弱电解质 |
| D.三种元素的电负性由大到小的顺序为Z>Y>W |
您最近一年使用:0次
2021-12-02更新
|
556次组卷
|
3卷引用:河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题
河北省石家庄市第二中学2022-2023学年高二上学期10月月考化学试题辽宁省沈阳市第一二〇中学2021-2022学年高二上学期期中考试化学试题(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)
名校
解题方法
3 . 完成下列问题
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第_______ 周期第_______ 族。
②基态C原子核外电子排布式为_______ ;基态N原子核外有_______ 种运动状态的电子。
③基态Si原子核外电子占据的最高能级的电子云轮廓图为_______ 形。
④Mg、Al 两种元素中第一电离能较大的是_______ (填元素符号),原因为_______ 。
(2)几种元素的电负性数据如下表:
①AlF3的熔点_______ AlBr3的熔点(填“大于”、“小于”或“等于”),原因是_______ 。
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为_______ 。
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为_______ 。
(1)C、N、Mg、Al、Si、Cu 是常见的六种元素,按要求回答下列问题:
①Cu位于元素周期表第
②基态C原子核外电子排布式为
③基态Si原子核外电子占据的最高能级的电子云轮廓图为
④Mg、Al 两种元素中第一电离能较大的是
(2)几种元素的电负性数据如下表:
| O | F | Al | Br | …… |
| 3.5 | 4.0 | 1.5 | 2.8 | …… |
②根据同一主族元素电负性递变规律,预测碘元素的电负性数值范围为
③卤族元素之间可以形成化合物,则氯元素与碘元素形成的化合物ICl中,碘元素的化合价为
您最近一年使用:0次
名校
4 . 下列说法正确的是
| A.电负性越大的元素对键合电子的吸引力强,其第一电离能也越大 |
B. 与 与 两种离子的空间构型相同,但其中心原子的杂化方式不同 两种离子的空间构型相同,但其中心原子的杂化方式不同 |
| C.H2O2与C2H2均为既含σ键又含π键的非极性分子 |
| D.NH3的稳定性强于AsH3的原因为NH3存在分子间氢键 |
您最近一年使用:0次
名校
5 . 用于制造隐形飞机的某化合物具有吸收微波功能,其结构如下图所示,其中X、Y、Z是周期序数递增的短周期主族元素。

下列说法错误的是

下列说法错误的是
| A.原子半径:Z>X | B.键角: | C.电负性:X<Y | D.第一电离能:Z>磷 |
您最近一年使用:0次
2023-10-25更新
|
188次组卷
|
3卷引用:河北昌黎第一中学2024届高三第六次调研考试化学试卷
6 . 下列有关性质的比较错误的是
| A.热稳定性:H2S<HCl | B.电负性:Cl>Br |
| C.第一电离能:S<P | D.离子半径:K+>Cl- |
您最近一年使用:0次
解题方法
7 . 短周期主族元素 W 、X 、Y 、Z 的原子序数依次增大,W 、X 原子的最外层电子数之比为 4 ∶3 ,Y 原子 p 能级上有 2 个未成对电子,Z 原子比 X 原子的核外电子数多 4 。下列说法正确的是
| A.X 、Y 、Z 的电负性大小顺序是X>Y>Z |
| B.WY2 分子构型为 V 形 |
| C.W 、X 、Y 、Z 的原子半径大小顺序是X>Y>Z>W |
| D.W 、Z 形成的分子的空间构型是正四面体形 |
您最近一年使用:0次
2022-11-02更新
|
223次组卷
|
2卷引用:河北省保定高碑店市崇德实验中学2022-2023学年高三上学期10月月考化学试题
名校
8 . 自然界中硫的分布很广,存在形式有硫化物、硫酸盐和单质硫。请回答下列问题:
(1)硫元素位于元素周期表中的_______ 区。基态硫原子核外有_______ 种空间运动状态不同的电子,未成对的电子数为_______ 。
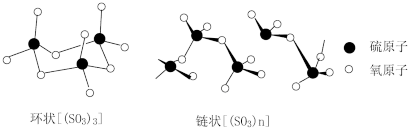
(2)三氧化硫是常见的硫的氧化物,液态三氧化硫有单分子[SO3]和三聚体([SO3)3]两种形式;固态三氧化硫主要以三聚体[(SO3)3]和无限长链[(SO3)n]两种形式存在。
①单分子[SO3]的空间构型为_______ 。
②环状[(SO3)3]和链状[(SO3)n]的结构如图所示。环状[(SO3)3]中硫原子的杂化轨道类型为_______ ,链状[(SO3)n]中发生杂化的氧原子有_______ (用含“n”的式子表示)个。
③常温下,单分子[SO3]是液体,而链状[(SO3)n]是固体的原因是_______ 。
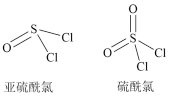
(3)硫的含氧衔生物——酰氯中亚硫酰氯和硫酰氯的结构如图所示,其中各元素电负性的大小顺序是_______ (用元素符号表示),两者中硫氯键之间的键角亚硫酰氯_______ (填“大于”“小于”或“等于”)硫酰氯。
(4)单质硫能与可溶性的金属硫化物溶液反应生成多硫化物(M2Sx),且多硫化物溶液的颜色随x的增大,越来越深。实验室中Na2S溶液长期放置颜色越来越深的原因是_______ 。
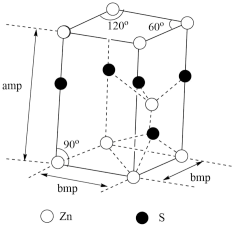
(5)含锌的某些硫化物具有独特的光电效应,广泛应用于荧光材料、电磁学等领域。某含锌硫化物的晶胞结构如图所示,该硫化物的化学式为_______ ,晶体中硫原子填充在锌原子构成的_______ 空隙中;若用NA表示阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(用含a、b、NA的式子表示)。
(1)硫元素位于元素周期表中的
(2)三氧化硫是常见的硫的氧化物,液态三氧化硫有单分子[SO3]和三聚体([SO3)3]两种形式;固态三氧化硫主要以三聚体[(SO3)3]和无限长链[(SO3)n]两种形式存在。
①单分子[SO3]的空间构型为
②环状[(SO3)3]和链状[(SO3)n]的结构如图所示。环状[(SO3)3]中硫原子的杂化轨道类型为
③常温下,单分子[SO3]是液体,而链状[(SO3)n]是固体的原因是

(3)硫的含氧衔生物——酰氯中亚硫酰氯和硫酰氯的结构如图所示,其中各元素电负性的大小顺序是

(4)单质硫能与可溶性的金属硫化物溶液反应生成多硫化物(M2Sx),且多硫化物溶液的颜色随x的增大,越来越深。实验室中Na2S溶液长期放置颜色越来越深的原因是
(5)含锌的某些硫化物具有独特的光电效应,广泛应用于荧光材料、电磁学等领域。某含锌硫化物的晶胞结构如图所示,该硫化物的化学式为

您最近一年使用:0次
2022-01-05更新
|
208次组卷
|
2卷引用:河北省神州智达省级联测2021-2022学年高三上学期第五次考试化学试题
名校
解题方法
9 . 由短周期元素组成的一种药物的分子结构式如图所示。其中,X原子的核外电子只有一种运动状态;元素Y、Z、W、E原子序数依次增大,基态W与E价电子排布均为ns2np5。下列说法不正确的是
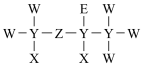
| A.元素电负性大小:X<Y<W |
| B.沸点高低:X2Z<X2Z2 |
| C.最简单气态氢化物分子的键长大小:E<W<Y |
| D.第一电离能大小:Y<Z<W |
您最近一年使用:0次
名校
10 . 下列各组元素中,电负性依次减小的是
| A.F、N、O | B.Cl、C、F | C.As、N、H | D.Cl、S、As |
您最近一年使用:0次
2022-01-21更新
|
374次组卷
|
6卷引用:河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题



