解题方法
1 . 物质的结构决定其性质。下列实例与解释不相符的是
| 选项 | 事实 | 解释 |
| A | 金属是电的良导体 | 金属晶体中的自由电子在外电场作用下发生定向移动 |
| B | NF3不易与Cu2+形成配位键 | F的电负性大,导致N原子核对其孤电子对的吸引力大 |
| C | CO的沸点高于N2 | CO的极性大于N2 |
| D |  中的键角小于 中的键角小于 | S的原子半径较大,其价层σ键电子对之间的斥力较小 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-13更新
|
550次组卷
|
5卷引用:河北省石家庄二中实验学校2023-2024学年高二下学期第一次月考化学试题
河北省石家庄二中实验学校2023-2024学年高二下学期第一次月考化学试题河北省石家庄市2024届高三下学期4月第二次质检化学试题河北省重点高中2023-2024学年高三下学期5月高考模拟化学试题(二)(已下线)选择题6-10(已下线)化学(天津卷01)-2024年高考押题预测卷
名校
解题方法
2 . 磷酸铁锂(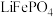 )电极材料主要用于各种锂离子电池。回答下列问题
)电极材料主要用于各种锂离子电池。回答下列问题
(1)Fe位于元素周期表中第___________ 周期第___________ 族,其外围电子排布式为___________ 。
(2)离子半径: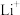
___________  ;第一电离能:Li
;第一电离能:Li___________ Be;电负性:O___________ P。(填“>”“<”或“=”)
(3)下列Li的轨道表示式表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
A. B.
B.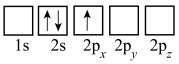
C.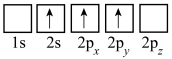 D.
D.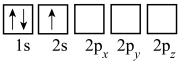
(4)基态P中未成对的电子数为___________ ,其原子核外电子占据的最高能级的电子云轮廓为___________ 形。
(5)Mn与Fe两元素的部分电离能数据如下,由表中两元素的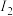 和
和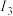 可知,气态
可知,气态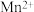 再失去一个电子比气态
再失去一个电子比气态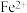 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是___________ 。
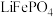 )电极材料主要用于各种锂离子电池。回答下列问题
)电极材料主要用于各种锂离子电池。回答下列问题(1)Fe位于元素周期表中第
(2)离子半径:
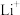
 ;第一电离能:Li
;第一电离能:Li(3)下列Li的轨道表示式表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.
(4)基态P中未成对的电子数为
(5)Mn与Fe两元素的部分电离能数据如下,由表中两元素的
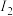 和
和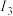 可知,气态
可知,气态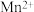 再失去一个电子比气态
再失去一个电子比气态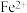 再失去一个电子更难,对此,你的解释是
再失去一个电子更难,对此,你的解释是| 元素 | Mn | Fe | |
| 电离能(kJ/mol) | 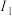 | 717 | 759 |
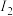 | 1509 | 1561 | |
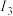 | 3248 | 2957 |
您最近一年使用:0次
2024-02-11更新
|
515次组卷
|
2卷引用:河北省邯郸市永年区第二中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
3 . 已知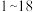 号元素的离子
号元素的离子 、
、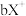 、
、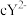 、
、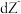 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是
 号元素的离子
号元素的离子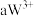 、
、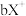 、
、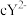 、
、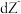 都具有相同电子层结构,下列关系正确的是
都具有相同电子层结构,下列关系正确的是A.质子数: ,离子的还原性: ,离子的还原性: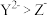 |
B.电负性: |
C.氢化物的稳定性: |
D.原子半径: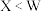 ,第一电离能: ,第一电离能: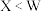 |
您最近一年使用:0次
2022-12-02更新
|
1076次组卷
|
34卷引用:2016-2017学年河北省衡水中学高二上学期五调考试化学试卷
2016-2017学年河北省衡水中学高二上学期五调考试化学试卷河北省石家庄市启明中学2019-2020学年高二四月月考化学试题2015-2016学年贵州省思南中学高二下第一次月考化学试卷2015-2016学年山西大学附属中学高二下3月月考化学试卷2015-2016学年吉林省汪清六中高二3月月考化学试卷2015-2016学年山西大学附中高二下3月月考化学试卷2016-2017学年河南省洛阳市第一高级中学高二(平行班)3月月考化学试卷2016-2017学年山西省大同市第一中学高二3月月考化学试卷河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:第一章 综合检测1吉林省辽源五中2017-2018学年高二下学期第一次月考化学试题【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题河南省林州市林虑中学2019-2020学年高二3月线上考试化学试题吉林省白山市第七中学2019-2020学年高二下学期3月份月考化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题黑龙江省黑河市第一中学2023-2024学年高二下学期4月月考化学试题内蒙古自治区赤峰第四中学2023-2024学年高二下学期4月月考化学试题福建省三明市第一中学2016-2017学年高二下学期半期考试化学试题贵州省思南中学2016-2017学年高二下学期期中考试化学试题人教版2017-2018学年高二化学选修三同步训练:第一章 原子结构与性质1【全国百强校】甘肃省嘉峪关市酒钢三中2017-2018学年高二下学期期中考试化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择提升专练】福建省厦门市思明区厦门外国语学校2019-2020学年高二上学期周末练习10——化学试题鲁科版(新)必修第二册第一章检测题辽宁省六校协作体2019-2020学年高二下学期期中考试化学试卷(鲁科版2019)选择性必修2 第1章 原子结构与元素性质 第3节 元素性质及其变化规律(人教版2019)选择性必修2 第一章 原子结构与性质 第二节 原子结构与元素的性质(人教版2019)选择性必修2第一章 原子结构与性质 第二节 原子结构与元素的性质 第3课时 元素的电负性及其变化规律鲁科版2019选择性必修2第1章 原子结构与元素性质 第3节 元素性质及其变化规律 第2课时 元素的电负性及其变化规律(已下线)模块同步卷03 第一章综合检测-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)专题强化练2 电离能和电负性的应用吉林省辉南县第六中学2022-2023学年高二上学期期中考试化学试题湖南省长沙市周南中学2022-2023学年高二上学期期末考试化学试题北京市第三十五中学2021-2022学年高三上学期期中考试化学试题
4 . “律动世界”国际化学元素周期表主题年活动报告中,提到了一种具有净水作用的物质,它由Q、W、X、Y、Z五种原子序数依次增大的元素组成。该五种元素的性质或结构信息如下表:
下列说法正确的是
| 元素 | 信息 |
| Q | 基态原子只有一种形状的轨道填有电子,并容易形成共价键 |
| W | 基态原子有5个原子轨道填充有电子,有2个未成对电子 |
| X | 最高价氧化物对应的水化物与Y、Z最高价氧化物对应的水化物都能反应 |
| Y | 在元素周期表中位于第3周期、第ⅥA族 |
| Z | 焰色反应为紫色 |
| A.电负性:Q<W<Y | B.第一电离能:W<X<Z |
| C.简单离子半径:X<W<Z<Y | D.这种物质只含离子键 |
您最近一年使用:0次
2022-11-02更新
|
1057次组卷
|
6卷引用:河北省张家口市张北县第一中学2022-2023学年高二下学期4月月考化学试题
名校
5 . 现有四种元素基态原子的电子排布式如下:①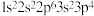 ②
② ③
③ ④
④ 。则下列有关比较中正确的是
。则下列有关比较中正确的是
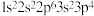 ②
② ③
③ ④
④ 。则下列有关比较中正确的是
。则下列有关比较中正确的是| A.第一电离能:④>③>①>② | B.原子半径:④>③>②>① |
| C.电负性:④>③>①>② | D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2021-02-01更新
|
1554次组卷
|
13卷引用:河北省石家庄市第二中学2022年高二寒假考试化学试题
河北省石家庄市第二中学2022年高二寒假考试化学试题吉林省洮南市第一中学2022-2023学年高二下学期学习质量检测化学试卷陕西省西安市陕西师范大学附属中学渭北中学2022-2023学年高二下学期5月月考化学试题安徽省安庆市怀宁县高河中学2023-2024学年高二下学期第一次月考化学试题(人教版2019)选择性必修2 阶段性综合评估测试卷(二)鲁科版2019选择性必修2阶段性综合评估测试卷(二)陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题重庆市朝阳中学2021-2022学年高二下学期期中考试化学试题湖北省武汉市钢城第四中学2021-2022学年高二下学期期中考试化学试题新疆维吾尔自治区塔城地区2022-2023学年高二下学期5月期中化学试题广东省揭阳市三所中学联考2022-2023学年高二下学期4月期中考试化学试题江西省丰城拖船中学2022-2023学年高二下学期6月期末考试化学试题吉林省长春市新解放学校2022-2023学年高二下学期7月期末考试化学试题
名校
6 . 有关周期表和周期律的说法正确的是
| A.周期表p区所有元素,电子最后填入的能级均为p能级 |
| B.第二周期元素,电离能介于B和N之间的元素有1种 |
| C.周期表第14列元素形成化合物种类最多 |
| D.同一周期,第ⅡA族元素电负性大于第ⅢA族元素 |
您最近一年使用:0次
2023-02-11更新
|
713次组卷
|
9卷引用:河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题
河北省邢台市重点高中联考2022-2023学年高二下学期6月月考化学试题山东省曹县第一中学2022-2023学年高二下学期2月月考化学试题天津市武清区城关中学、杨村第四中学、黄花店中学2022-2023学年高二下学期第一次阶段考化学试题湖北省荆州市沙市中学2022-2023学年高二下学期2月月考化学试题山东省济宁市2022-2023学年高二上学期期末考试化学试题广东省梅州市梅州五校2022-2023学年高二下学期4月期中联考化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题广东番禺中学2022-2023学年高二下学期4月期中考试化学试题河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷
名校
解题方法
7 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Z处于同一主族,Y是短周期中电负性最大的元素,Z是同周期基态原子中未成对电子数最多的元素,W的族序数是周期序数的2倍。下列有关说法正确的是
| A.元素Z在周期表中位于第3周期VA族 |
| B.原子半径:r(X)<r(Y) |
| C.Z的第一电离能比W的小. |
| D.X的简单气态氢化物的热稳定性比Z的弱 |
您最近一年使用:0次
2022-04-02更新
|
584次组卷
|
2卷引用:河北省唐山市第一中学2022-2023学年高三上学期12月月考化学试题
名校
8 . 光伏材料又称太阳能材料,能将太阳能直接转换成电能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CaS、CdTe、CuInSe等。
(1)元素铜在元素周期表中位于___________ 区,基态铬(Cr)原子的价电子轨道表示式为___________ 。
(2)P、S、Cl元素的电负性从大到小的顺序为___________ ,其中电负性最小的元素原子价电子排布式为___________ 。
(3)As元素的第一电离能___________ (填“大于”“小于”或“等于”)Se元素的第一电离能,原因是___________ 。
(4)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲合能( )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中,除了氮元素外,其他元素的
变化趋势如图所示,其中,除了氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是___________ ;氮元素的 呈现异常的原因是
呈现异常的原因是___________ 。
(1)元素铜在元素周期表中位于
(2)P、S、Cl元素的电负性从大到小的顺序为
(3)As元素的第一电离能
(4)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称为第一电子亲合能(
 )。第二周期部分元素的
)。第二周期部分元素的 变化趋势如图所示,其中,除了氮元素外,其他元素的
变化趋势如图所示,其中,除了氮元素外,其他元素的 自左而右依次增大的原因是
自左而右依次增大的原因是 呈现异常的原因是
呈现异常的原因是
您最近一年使用:0次
2023-12-13更新
|
422次组卷
|
3卷引用:河北省保定市高碑店市崇德实验中学2023-2024学年高二上学期12月考试化学试题
名校
解题方法
9 . 基于所学内容回答问题
(1)基态铜原子的价电子排布式为_________ ,其核外电子的空间运动状态有________ 种;As原子的价电子排布图为________________ 。
(2) 与
与 同周期,
同周期,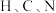 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为________ ; 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为________________ 。
(3) 的电子式
的电子式_________ , 的沸点高于
的沸点高于 的原因是
的原因是_________ 。
(4)已知 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是__________________ 。
(5)铜的某种氧化物的晶胞结构如图所示,若该晶胞中 原子与
原子与 原子之间的最近距离为apm,设阿伏加德罗常数的值为
原子之间的最近距离为apm,设阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为_________  (填含
(填含 的表达式)。
的表达式)。
(1)基态铜原子的价电子排布式为
(2)
 与
与 同周期,
同周期,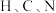 三种元素的电负性从小到大的顺序为
三种元素的电负性从小到大的顺序为 、
、 、
、 的第一电离能从大到小的顺序为
的第一电离能从大到小的顺序为(3)
 的电子式
的电子式 的沸点高于
的沸点高于 的原因是
的原因是(4)已知
 的熔点高于
的熔点高于 的熔点,其原因是
的熔点,其原因是(5)铜的某种氧化物的晶胞结构如图所示,若该晶胞中
 原子与
原子与 原子之间的最近距离为apm,设阿伏加德罗常数的值为
原子之间的最近距离为apm,设阿伏加德罗常数的值为 ,则该晶胞的密度为
,则该晶胞的密度为 (填含
(填含 的表达式)。
的表达式)。 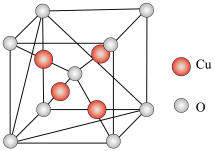
您最近一年使用:0次
2024-01-23更新
|
391次组卷
|
2卷引用:河北省沧州市泊头市第一中学2023-2024学年高二上学期12月月考化学试题
10 . 科学家发现固体电解质 具有良好的导电能力,为锂离子电池的发展做出了重要贡献,其晶胞结构如图所示,其中
具有良好的导电能力,为锂离子电池的发展做出了重要贡献,其晶胞结构如图所示,其中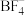 位于体心。下列说法正确的是
位于体心。下列说法正确的是
 具有良好的导电能力,为锂离子电池的发展做出了重要贡献,其晶胞结构如图所示,其中
具有良好的导电能力,为锂离子电池的发展做出了重要贡献,其晶胞结构如图所示,其中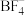 位于体心。下列说法正确的是
位于体心。下列说法正确的是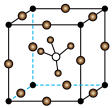
A.该晶胞中 位于体心和棱心 位于体心和棱心 |
B.电负性: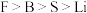 |
C. 周围距离最近且相等的 周围距离最近且相等的 的个数为4 的个数为4 |
D.若晶胞参数为 ,则晶体密度为 ,则晶体密度为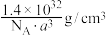 |
您最近一年使用:0次
2023-01-16更新
|
424次组卷
|
4卷引用:河北省保定市唐县第一中学2023-2024学年高二下学期3月月考化学试题



