名校
解题方法
1 . 离子液体被广泛应用于化学研究的各个领域。某种离子液体的结构如图所示,X、Y、Z、Q、W为原子序数依次增大的短周期元素,Y、Z、Q、W均位于第二周期,且价电子总数为19。下列说法一定正确的是
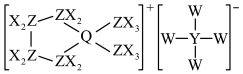
| A.氢化物的沸点:Z<Q |
| B.基态原子未成对电子数:Q<W |
| C.最高价含氧酸的酸性:Y>Z |
| D.电负性:Z>X |
您最近一年使用:0次
解题方法
2 . Se是迄今为止发现的最重要的抗衰老元素,也有抗癌之王的美誉。回答下列问题:
(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有_____ 个;第四周期的过渡金属中,基态原子核外未成对电子数与基态Se原子相同的有____ 种。
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为____ 。
(3) H2Se属于____ (填“极性”或“非极性”)分子;其熔点低于同条件下NaH熔点的原因为______ 。
(4) SeO2的立体构型为____ 。SeO3中Se原子的杂化形式为____ 。
(5)写出一种与SeO42-互为等电子体的分子式____ .
(6)Se能与 形成具有多种生物活性的配合物。1mol
形成具有多种生物活性的配合物。1mol 中含有σ键的数目为
中含有σ键的数目为 ___ 。
(7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为apm,阿伏伽德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为___ 。(列出计算式即可)

(1)基态Se原子核外电子占据的轨道中,电子云轮廓图形状为哑铃形的有
(2)Se及其同周期相邻元素相比,三种元素的基态原子的第一电离能由大到小的顺序为
(3) H2Se属于
(4) SeO2的立体构型为
(5)写出一种与SeO42-互为等电子体的分子式
(6)Se能与
 形成具有多种生物活性的配合物。1mol
形成具有多种生物活性的配合物。1mol 中含有σ键的数目为
中含有σ键的数目为 (7)硒化锌是一种重要的半导体材料,其立方晶胞结构如图所示。若晶胞参数为apm,阿伏伽德罗常数的值为NA晶体密度为ρ g·cm-3,则硒化锌的摩尔质量可表示为

您最近一年使用:0次
3 . 硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
(1)基态Cu+的核外价层电子排布式为_______________ ;Be、B、Al的第一电离能由大到小的顺序是______________________________ 。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______ ,与其互为等电子体的一种分子的分子式是______________ 。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________ ,Cu(NO3)2中的化学键除了σ键外,还存在_______________ 。
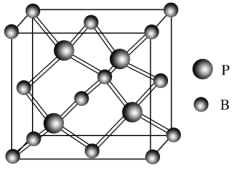
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________ ,已知该晶体的晶胞参数a pm,用NA代表阿伏伽德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________ pm。
(1)基态Cu+的核外价层电子排布式为
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(3)SeO32-中Se原子的杂化类型为
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为

您最近一年使用:0次
解题方法
4 . 镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____ ,同周期元素中基态原子与镍具有相同未成对电子的还有____ 种。
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___ 三种组成元素按电负性由大到小的顺序为____ 。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____ ,写出与SO42-互为等电子体的一种分子和一种离子的化学式____ ,____ ;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___ (填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
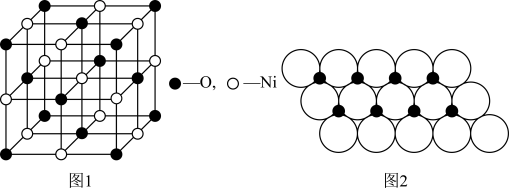
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____ 体空隙中,其空隙的填充率为____ 。
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___ g。(用a、NA表示)
(1)基态镍原子的价电子排布图为
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为
NH3)4]SO4中H-N-H键之间的夹角
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的

(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为
您最近一年使用:0次
名校
解题方法
5 . Cu、Fe、Se、Co、Si常用于化工材料的合成。请回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______ ,其核外共有______ 种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________ (用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有____ 、_____ 。
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式_____ ,HCN分子的空间构型为____________ 。
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为_________ ,每个Si原子被_______ 个最小环所共有。
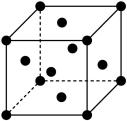
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为____ mol-1。
(1)铁离子(Fe3+)最外层电子排布式为
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为

您最近一年使用:0次
名校
解题方法
6 . 一种可用作有机化工原料的化合物Q的结构如图。已知X、Y、Z、W、M为原子序数依次增大的主族元素,其中X的核电荷数等于其主族序数,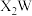 是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是
是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是
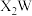 是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是
是常温下常见的液态化合物,基态Y原子核外未成对电子数与基态W原子核外未成对电子数相等,M的单质是常温下唯一的液态非金属单质。下列说法正确的是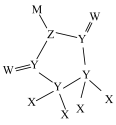
| A.原子半径:W>Z>Y | B.第一电离能:Z>W>Y |
| C.电负性:M>W>Z | D.键角: |
您最近一年使用:0次
2024-05-22更新
|
162次组卷
|
4卷引用:2024届河北省保定市十校高三下学期三模化学试题
名校
7 . 分子结构决定分子的性质,下列关于分子结构与性质的说法正确的是
| A.乙醚是非极性分子,乙醇是极性分子,因此乙醚在水中的溶解度比乙醇小 |
B.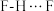 中的氢键键能小于 中的氢键键能小于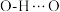 ,因此 ,因此 的沸点比 的沸点比 高 高 |
| C.从葡萄中提取的酒石酸盐具有光学活性,因此酒石酸盐中含有手性碳原子 |
D.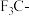 是吸电子基团, 是吸电子基团,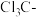 是推电子基团,因此 是推电子基团,因此 的酸性强于 的酸性强于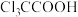 |
您最近一年使用:0次
解题方法
8 . 科学家发现铂金按一定比例混合可以获得迄今为止最强的合金。该合金的耐磨性比高强度钢高100倍,可用于制造新型发电系统,发动机和其他设备。已知金为第六周期元素,与铜均属ⅠB族。回答下列问题:
(1)基态Au原子中,核外电子占据的最低能层符号是_________ ,其价电子层的电子排布式为___________ ,简要说明Au熔点低于Cu熔点的原因__________ 。
(2)金、氯两种元素的电负性如下表。AuCl属于_________ (填“共价”或“离子”)化合物。
(3)Au易溶于王水的原因是形成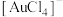 。
。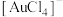 的配位数是
的配位数是____ ,该离子的结构式为____ 。
(4)用 作催化剂可完成甲醇脱氢,最优路径为
作催化剂可完成甲醇脱氢,最优路径为 。等物质的量的甲醇与一氧化碳中
。等物质的量的甲醇与一氧化碳中 键的数目比为
键的数目比为_____________ 。
(5)利用X—射线衍射法发现金(Au)晶体的晶胞如图所示。该晶体的密度为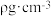 ,晶胞的边长为apm,则阿伏加 德罗常数为
,晶胞的边长为apm,则阿伏加 德罗常数为_______________ (用含 的代数式表示)
的代数式表示) 。
。

(1)基态Au原子中,核外电子占据的最低能层符号是
(2)金、氯两种元素的电负性如下表。AuCl属于
| 元素 | Au | Cl |
| 电负性 | 2.54 | 3.2 |
(3)Au易溶于王水的原因是形成
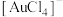 。
。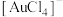 的配位数是
的配位数是(4)用
 作催化剂可完成甲醇脱氢,最优路径为
作催化剂可完成甲醇脱氢,最优路径为 。等物质的量的甲醇与一氧化碳中
。等物质的量的甲醇与一氧化碳中 键的数目比为
键的数目比为(5)利用X—射线衍射法发现金(Au)晶体的晶胞如图所示。该晶体的密度为
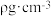 ,晶胞的边长为apm,则阿伏加 德罗常数为
,晶胞的边长为apm,则阿伏加 德罗常数为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
解题方法
9 . 铜元素可形成多种重要化合物。回答下列问题:
(1)铜元素位于元素周期表中的_____ 区,其基态原子的价电子排布图为_________ 。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是__________ 。
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为______ ,提供孤电子对的成键原子是_________ 。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为________ 。
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为_________ 。但NF3不易与Cu2+形成化学键,其原因是_______________ 。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。
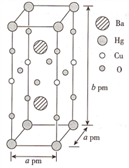
①该物质的化学式为__________ 。
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为_____ 个,二者的最短距离为_______ pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为______ g·cm-3。
(1)铜元素位于元素周期表中的
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为
④NF3与NH3 的空间构型相同,中心原子的轨道杂化类型均为
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为
②已知该晶胞中两个Ba2+的间距为c pm.则距离Ba2+最近的Hg+数目为
③设该物质的摩尔质量为M,阿伏伽德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
2017-12-27更新
|
353次组卷
|
4卷引用:河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题
河北省沧州市普通高中高三上学期教学质量监测(联考)化学试题(已下线)2021年高考化学押题预测卷(湖南卷)(01)(含考试版、答题卡、参考答案、全解全析)2020高考化学二轮总复习高分必备 题型专题2 非选择题专练(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编
名校
10 . 由H、C和与C处于同周期的X、Y四种元素组成的穴醚的结构如图,所有原子均满足稳定结构,其空腔直径大约为260~320pm。下列说法正确的是

| 离子 | 直径/pm |
 | 204 |
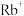 | 304 |
A.电负性: |
| B.简单氢化物的沸点:X>Y |
C.键角: |
D.该穴醚可与 通过配位键形成超分子,对 通过配位键形成超分子,对 进行识别 进行识别 |
您最近一年使用:0次



