1 . 下图中两种化合物常用来优化电池的性能,其中W、M、Q、X、Y、Z是原子序数依次增大的短周期主族元素.下列说法错误的是
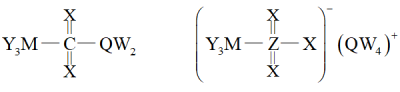
A.含氧酸的酸性: |
B.电负性: ;第一电离能: ;第一电离能: |
| C.仅由W、Q、Y三种元素可形成同时含有离子键和共价键的化合物 |
| D.上述两种化合物中,W、M、Q、X、Y均满足稀有气体的稳定电子构型 |
您最近一年使用:0次
2024-06-01更新
|
271次组卷
|
2卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷
解题方法
2 . 核酸检测样品盛放在含有胍盐的标本保存液中,胍盐可以灭活病毒,有效保存多种病毒核酸。胍的结构简式如图,分子构型为平面型,有关说法正确的是
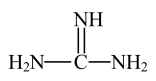
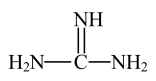
A.胍是含氮有机物,所含元素的电负性大小顺序为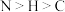 |
| B.胍分子中C原子和3个N原子的杂化方式相同 |
C.晶体易吸收空气中 生成碳酸盐 生成碳酸盐 |
| D.胍分子中两个单键N原子与C原子形成的N−C−N键角大于120° |
您最近一年使用:0次
3 . 过渡元素钉(Ru)及其化合物用途广泛。利用水合肼( )还原
)还原 时获得了一种新的配合物
时获得了一种新的配合物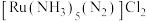 ,其配离子
,其配离子 结构如图。
结构如图。
 )还原
)还原 时获得了一种新的配合物
时获得了一种新的配合物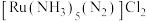 ,其配离子
,其配离子 结构如图。
结构如图。
A.在水合肼和 所含非金属元素中,电负性最大的元素为O 所含非金属元素中,电负性最大的元素为O |
B.当 形成配离子 形成配离子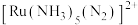 后, 后, 的键长将减小 的键长将减小 |
C.同周期且基态原子的单电子数与 相同的元素有2种 相同的元素有2种 |
D. 中心原子配位数为6 中心原子配位数为6 |
您最近一年使用:0次
解题方法
4 . 硅与碳同主族,是构成地壳的主要元素之一,下列说法正确的是
| A.键能:Si-Si<C-C |
B. 和 和 中C、Si化合价均为-4价 中C、Si化合价均为-4价 |
| C.硅酸盐与碳酸盐中Si、C原子的杂化方式相同 |
D.相比较碳原子,硅与硅之间更易形成 键 键 |
您最近一年使用:0次
2023-04-29更新
|
216次组卷
|
2卷引用:河北省部分学校2023届高三下学期大数据应用调研联合测评化学试题
名校
解题方法
5 . 硫氰酸甲基铵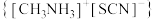 用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(
用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(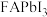 )和一种新型光电材料铯铜卤化物
)和一种新型光电材料铯铜卤化物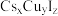 。请回答下列问题:
。请回答下列问题:
(1)基态Cu原子的电子排布式为_______ 。基态I原子的价电子排布图为_______ 。
(2)硫氰酸甲基铵所含元素中第一电离能最大的是_______ (填元素符号)。
(3)Cs、Cu、I的电负性由大到小的顺序是_______ 。
(4)甲脒( )与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是
)与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是_______ 。甲脒中碳原子的杂化方式为_______ 。
(5)水中铅的测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(结构如图)。_______ 。
②该络合物分子内不存在的微粒间作用力有_______ (填标号)。
a. 键 b.
键 b. 键 c.非极性键 d.离子键 e.配位键
键 c.非极性键 d.离子键 e.配位键
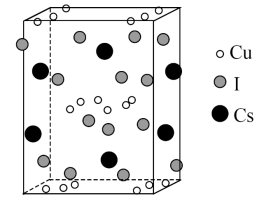
(6)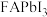 的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为
的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为_______ 。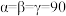 °,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为
°,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为_______  。
。
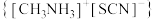 用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(
用于抗生素的分离、分析农药含量、硫氰酸络盐的合成以及用作聚合催化剂。通过气相辅助生长技术,利用硫氰酸甲基铵可制得钙钛矿型甲脒铅碘(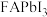 )和一种新型光电材料铯铜卤化物
)和一种新型光电材料铯铜卤化物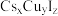 。请回答下列问题:
。请回答下列问题:(1)基态Cu原子的电子排布式为
(2)硫氰酸甲基铵所含元素中第一电离能最大的是
(3)Cs、Cu、I的电负性由大到小的顺序是
(4)甲脒(
 )与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是
)与丙烷的相对分子质量相同,但甲脒的熔点比丙烷的熔点高得多,其原因是(5)水中铅的测定方法是用双硫腙与铅反应生成红色双硫腙铅络合物(结构如图)。
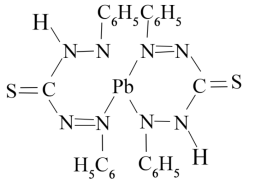
②该络合物分子内不存在的微粒间作用力有
a.
 键 b.
键 b. 键 c.非极性键 d.离子键 e.配位键
键 c.非极性键 d.离子键 e.配位键(6)
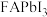 的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为
的晶体结构单元如图所示,图中X表示FA,Y表示Pb,位于八面体中心,则X的碘配位数为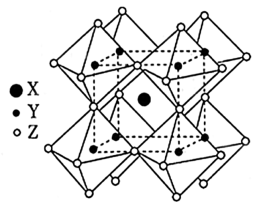
 °,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为
°,晶胞的棱上有8个Cu原子,面上有8个Cu原子、4个Cs原子和4个I原子,其余原子均位于体内,该晶体的密度为 。
。
您最近一年使用:0次
2022-03-08更新
|
420次组卷
|
3卷引用:河北省部分名校2021-2022学年高三下学期3月份联考考试化学试题
名校
6 . 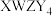 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是
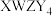 是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系:
是构成电池的一种重要化合物,其阴离子结构如图所示,X、Y、Z、W为原子序数依次增大的前四周期元素,其中Y、Z为非金属元素且位于相邻主族,四种基态原子未成对电子数均不相等且不为0,未成对电子数存在关系: 。下列说法错误的是
。下列说法错误的是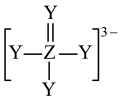
| A.电负性:Y>Z>X | B.W能与Y的简单氢化物反应生成 |
C.该化合物中Z采用 杂化 杂化 | D.Y元素形成的单质一定为非极性分子 |
您最近一年使用:0次
2024-04-19更新
|
181次组卷
|
4卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高三下学期4月模拟测试化学试题
解题方法
7 .  有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
(1)基态Co原子的价层电子排布图为______ ;金属Co的熔点、沸点均高于金属K的原因为______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为______ ;C、N、O、F的第一电离能由大到小的顺序为______ 。
(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
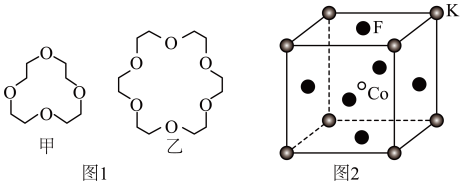
①冠醚中O原子的杂化形式为______ ;H、C、O的电负性由小到大的顺序为______ 。
② 不能镶入甲中而易镶入乙中的原因为
不能镶入甲中而易镶入乙中的原因为______ 。
(4) 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
①每个晶胞中由K和F共同形成的正四面体空隙有______ 个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于______ 位置。
③若晶胞参数为a pm,阿伏加德罗常数的值为 ,晶体密度ρ=
,晶体密度ρ=______  。
。
 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:
有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:(1)基态Co原子的价层电子排布图为
(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。

①冠醚中O原子的杂化形式为
②
 不能镶入甲中而易镶入乙中的原因为
不能镶入甲中而易镶入乙中的原因为(4)
 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。
具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。①每个晶胞中由K和F共同形成的正四面体空隙有
②晶胞的另一种表示中,Co处于各顶角位置,则K处于
③若晶胞参数为a pm,阿伏加德罗常数的值为
 ,晶体密度ρ=
,晶体密度ρ= 。
。
您最近一年使用:0次
2021-04-10更新
|
474次组卷
|
4卷引用:河北省张家口市2021届高三第二次模拟考试化学试题
河北省张家口市2021届高三第二次模拟考试化学试题河北省承德市2021届高三下学期第二次模拟考试化学试题(已下线)2021年高考化学押题预测卷(河北卷)(01)(含考试版、答题卡、参考答案、全解全析)(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)
名校
解题方法
8 . 短周期元素W、X、Y、Z的原子序数依次增大,它们组成一种团簇分子,结构如图所示。W、Z的族序数均等于周期序数,X原子核外最外层电子数是其电子总数的 ,下列说法正确的是
,下列说法正确的是
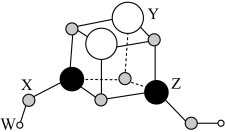
 ,下列说法正确的是
,下列说法正确的是
| A.电负性:X<Y<Z |
| B.常温下,W与X形成的化合物呈液态 |
| C.该团簇分子中原子均满足8电子稳定结构 |
| D.最高价氧化物的水化物的碱性:Y<Z |
您最近一年使用:0次
2023-08-14更新
|
251次组卷
|
2卷引用:河北省部分学校2023届高三4月大联考二模化学试题
名校
解题方法
9 . 铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式为________ 。
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
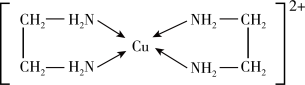
①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为________ ,C、N、H三种元素的电负性由大到小顺序是 ___ 。
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是________ 。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是______ 。
(4)Cu和S形成某种晶体的晶胞如图所示。
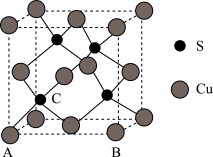
①该晶体的化学式为________ 。
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为________
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率________ 。
(1)铜元素基态原子的价电子排布式为
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是
(4)Cu和S形成某种晶体的晶胞如图所示。

①该晶体的化学式为
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率
您最近一年使用:0次
2020-09-01更新
|
807次组卷
|
4卷引用:河北省河北衡水中学2021届高三下学期第二次调研考试化学试题
解题方法
10 . 镍电池广泛应用于混合动力汽车系统,电极材料由 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
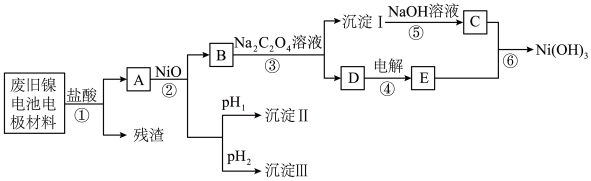
已知:a. 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。
b.实验温度时的溶解度:
c.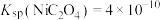
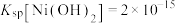
d.实验温度下相关金属离子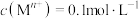 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:
回答下列问题:
(1)加入盐酸溶液所得残渣的主要成分为___________ (填物质名称)。
(2)根据信息判断步骤②先析出的沉淀Ⅱ为___________ (填化学式),控制两种沉淀析出可利用___________ (填序号)。
A. 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂
(3)该工艺流程中多次重复利用的一种实验基本操作是___________ ,可以循环使用的物质是___________ (填化学式)。
(4) 的价电子轨道表示式为
的价电子轨道表示式为___________ ,N、O、S的电负性由大到小的顺序为___________ ,硫氰酸分子 中
中 键和
键和 键之比为
键之比为___________ ,与 互为等电子体的分子是
互为等电子体的分子是___________ 。
(5)步骤③的化学方程式为___________ 。
(6)步骤⑥的离子方程式为___________ 。
 、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
已知:a.
 易溶于水,
易溶于水, 不能氧化
不能氧化 。
。b.实验温度时的溶解度:

c.
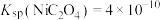
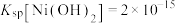
d.实验温度下相关金属离子
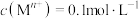 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.7 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 3.2 | 4.7 | 8.9 |
(1)加入盐酸溶液所得残渣的主要成分为
(2)根据信息判断步骤②先析出的沉淀Ⅱ为
A.
 试纸 B.
试纸 B. 计 C.石蕊指示剂
计 C.石蕊指示剂(3)该工艺流程中多次重复利用的一种实验基本操作是
(4)
 的价电子轨道表示式为
的价电子轨道表示式为 中
中 键和
键和 键之比为
键之比为 互为等电子体的分子是
互为等电子体的分子是(5)步骤③的化学方程式为
(6)步骤⑥的离子方程式为
您最近一年使用:0次



