2022·河北·模拟预测
1 . 硼及其化合物是用途广泛的化工原料,可以应用于新型材料的制备。回答下列问题:
(1)基态硼原子的价电子排布式为___________ ;与硼同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为___________ 。
(2)碳化硼(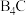 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于___________ 晶体。原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为___________ 。
(3)自然界中含硼钠盐是一种天然矿藏,其化学式为 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________ (填标号)。
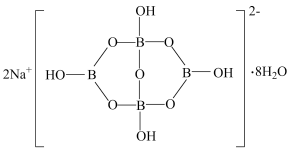
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4) 的空间构型为
的空间构型为___________ , 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因___________ 。
(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有___________ ,组成该有机物的第二周期元素电负性由大到小的顺序为___________ 。

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为___________ (填标号)。

②若晶胞的边长为apm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为___________  (列出计算表达式)。
(列出计算表达式)。
(1)基态硼原子的价电子排布式为
(2)碳化硼(
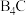 )硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于
)硬度较大,可用于坦克车的装甲、避弹衣等。碳化硼的熔点为2350℃、沸点为3500℃,说明它属于 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的碳原子,其价电子自旋磁量子数的代数和为(3)自然界中含硼钠盐是一种天然矿藏,其化学式为
 ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
。其结构如图,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(4)
 的空间构型为
的空间构型为 的键角大于
的键角大于 的键角,解释其原因
的键角,解释其原因(5)某有机硼化物的结构简式如图2,该有机物中其他中心原子与B原子杂化类型相同的元素有

(6)砷化硼的晶胞结构如图3,图4中矩形AA’C’C是沿晶胞对角面取得的截图。
①晶胞中各原子在矩形AA’C’C中的位置为

②若晶胞的边长为apm,阿伏加德罗常数的值为
 ,则晶体的密度为
,则晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
解题方法
2 . 下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 三氟乙酸酸性强于三氯乙酸 | F原子电负性大于Cl原子,吸电子能力强 |
| B | 常温下,铜与稀硫酸不反应,与稀硝酸反应 | 硝酸酸性强于硫酸 |
| C | 常温下溶解度: 大于 大于 |  水解程度大于 水解程度大于 |
| D |  、 、 混合气体通入 混合气体通入 溶液中产生的白色沉淀是 溶液中产生的白色沉淀是 | 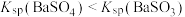 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 短周期主族元素W、X、Y、Z的原子序数依次增大,其中X、Y、Z同周期,X原子的电子数等于Y原子的最外层电子数。W、X、Y形成的分子的结构如图所示。下列说法正确的是


| A.电负性:W<X<Y<Z |
| B.W、Y、Z可形成离子晶体 |
| C.Y与Z形成的化合物均可被强碱溶液吸收 |
| D.W分别与Y、Z形成简单化合物的沸点:Y>Z |
您最近一年使用:0次
4 . 某种化学电源电解液的组成与结构如图所示, 为原子序数依次增大的短周期元素,且五种元素分别属于不同主族。下列说法错误的是
为原子序数依次增大的短周期元素,且五种元素分别属于不同主族。下列说法错误的是
 为原子序数依次增大的短周期元素,且五种元素分别属于不同主族。下列说法错误的是
为原子序数依次增大的短周期元素,且五种元素分别属于不同主族。下列说法错误的是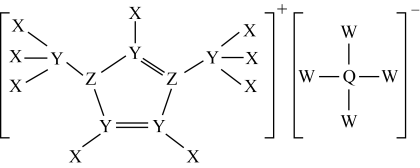
A.简单离子半径: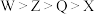 | B.电解熔融的 可获得 可获得 单质 单质 |
C.电负性: | D.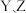 与 与 均可形成含非极性键的化合物 均可形成含非极性键的化合物 |
您最近一年使用:0次
2024-04-18更新
|
220次组卷
|
2卷引用:河北省沧州市2024届普通高中高三下学期总复习质量监测(二模)化学试题
5 . 物质结构决定物质性质,下列性质不能通过元素的电负性进行解释的是
A. 的沸点高于 的沸点高于 的沸点 的沸点 |
| B.乙烯能发生加成反应,而乙烷不能 |
C. 酸性大于 酸性大于 的酸性 的酸性 |
D.气态氟化氢中存在 分子,而气态氯化氢中只存在 分子,而气态氯化氢中只存在 分子 分子 |
您最近一年使用:0次
2024-04-10更新
|
262次组卷
|
2卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高三下学期模拟演练化学试题
解题方法
6 . X、Y、Z、M是电负性逐渐减小的短周期非金属元素。X、Z、M位于三个不同周期,Y与Z的价电子数之和为M价电子数的两倍;化合物 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是
 的电子总数为18个。下列说法错误的是
的电子总数为18个。下列说法错误的是| A.Y的含氧酸为弱酸 |
| B.Z与M形成的化合物具有较强的还原性 |
| C.简单氢化物的稳定性:X>Y>M |
| D.原子半径:Z<X<Y<M |
您最近一年使用:0次
名校
7 . 下列说法错误的是
A. 的空间结构模型为 的空间结构模型为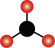 |
B.钠、镁、铝三种元素的电负性和第一电离能由小到大的顺序均为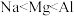 |
C.过氧化钠的电子式为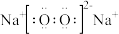 |
D.基态硫原子的价层电子排布图为 |
您最近一年使用:0次
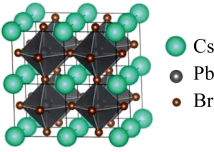
8 . 一种无机纳米晶体材料,仅由铯、铅、溴三种元素构成,在太阳能电池方向有巨大应用前景。回答下列问题:
(1)基态 原子核外电子占据能量最高的能级的电子云轮廓图形状为
原子核外电子占据能量最高的能级的电子云轮廓图形状为_______ 。 属于
属于_______ 区元素。
(2)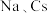 位于同主族,
位于同主族,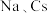 元素的第一电离能分别为
元素的第一电离能分别为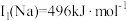 、
、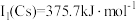 。
。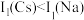 的原因是
的原因是_______ 。
(3) 三种元素的电负性如下表。
三种元素的电负性如下表。 具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是
具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是_______ 。
(4)该晶体材料的立方结构如图所示,其化学式为_______ 。若其晶胞参数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度=
,则该晶体密度=_______  。
。
(5)该晶体材料电池并未实现商业化,原因在于自身的不稳定性。
①该晶体材料在潮湿环境中易从固体变成溶液(发生相变),导致器件效率降低,其原因是_______ 。
②某大学采用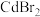 对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,
对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,_______ (离子)脱离晶格,用 钝化后的晶体比原晶体材料更稳定,其原因是
钝化后的晶体比原晶体材料更稳定,其原因是_______ 。
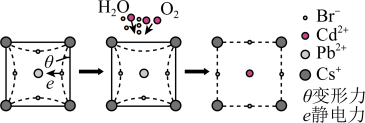
(已知:应力与应变相伴而生,从原子尺度上来理解,应力为单位晶格上的作用力,应变即为晶格的拉伸或收缩,对应于拉伸应变和压缩应变。对应出现的驰豫是指一个宏观平衡系统由于受到外界的作用变为非平衡状态,再从非平衡状态过渡到新的平衡态的过程。)
(1)基态
 原子核外电子占据能量最高的能级的电子云轮廓图形状为
原子核外电子占据能量最高的能级的电子云轮廓图形状为 属于
属于(2)
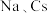 位于同主族,
位于同主族,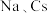 元素的第一电离能分别为
元素的第一电离能分别为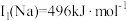 、
、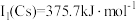 。
。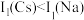 的原因是
的原因是(3)
 三种元素的电负性如下表。
三种元素的电负性如下表。 具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是
具有较高的熔点(855℃),PbBr2具有较低的熔点(373℃),原因是| 电负性 | ||
| F | Br | Pb |
| 4.0 | 2.8 | 1.9 |
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体密度=
,则该晶体密度= 。
。
(5)该晶体材料电池并未实现商业化,原因在于自身的不稳定性。
①该晶体材料在潮湿环境中易从固体变成溶液(发生相变),导致器件效率降低,其原因是
②某大学采用
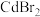 对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,
对该材料进行钝化处理可有效提高其稳定性,钝化机理如图所示。根据晶格应变驰豫,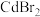 钝化后的晶体比原晶体材料更稳定,其原因是
钝化后的晶体比原晶体材料更稳定,其原因是
(已知:应力与应变相伴而生,从原子尺度上来理解,应力为单位晶格上的作用力,应变即为晶格的拉伸或收缩,对应于拉伸应变和压缩应变。对应出现的驰豫是指一个宏观平衡系统由于受到外界的作用变为非平衡状态,再从非平衡状态过渡到新的平衡态的过程。)
您最近一年使用:0次
名校
解题方法
9 . 非金属在生产,生活和科研中应用广泛。
(1)下列说法正确的是___ 。
A.O元素的电负性大于Cl元素
B.3s电子能量高于2s,故3s电子一定在离核更远处运动
C.组成KH2PO4的四种元素形成的简单离子中,核外电子排布相同的有3种
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为___ 。
(3)CH3OH的沸点___ CH3SH,(填“高于”,“低于”或“等于”),原因是____ 。
(4)Xe是第五周期的稀有气体元素,与F形成的XeF4中心原子的价层电子对数为____ ,下列对XeF4中心原子杂化方式推断合理的是___ (填标号)。
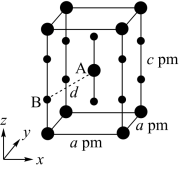
A.sp B.sp2 C.sp3d2 D.sp3d
(5)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有___ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为____ ;晶胞中A、B间距离d=___ pm。
(1)下列说法正确的是
A.O元素的电负性大于Cl元素
B.3s电子能量高于2s,故3s电子一定在离核更远处运动
C.组成KH2PO4的四种元素形成的简单离子中,核外电子排布相同的有3种
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的氟原子,其价电子自旋磁量子数的代数和为(3)CH3OH的沸点
(4)Xe是第五周期的稀有气体元素,与F形成的XeF4中心原子的价层电子对数为
A.sp B.sp2 C.sp3d2 D.sp3d
(5)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
2021-09-06更新
|
508次组卷
|
2卷引用:2021年河北省高考化学试卷变式题10-18题
10 . 下图中两种化合物常用来优化电池的性能,其中W、M、Q、X、Y、Z是原子序数依次增大的短周期主族元素.下列说法错误的是
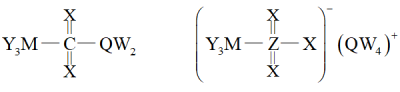
A.含氧酸的酸性: |
B.电负性: ;第一电离能: ;第一电离能: |
| C.仅由W、Q、Y三种元素可形成同时含有离子键和共价键的化合物 |
| D.上述两种化合物中,W、M、Q、X、Y均满足稀有气体的稳定电子构型 |
您最近一年使用:0次
2024-06-01更新
|
262次组卷
|
2卷引用:河北省石家庄市2024届普通高中学校高三毕业年级教学质量检测(三)化学试卷



