1 . 光刻技术需要利用深紫激光,我国是唯掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体KBBF(KBe2BO3F2), 实验室可用BeO、KBF4 和B2O3在700°C左右灼烧获得氟代硼铍酸钾晶体(晶胞如下图所示,其中K原子已经给出,氧原子略去),并放出BF3气体。
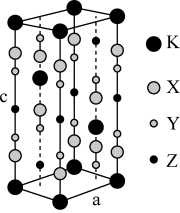
回答下列问题:
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________________ 。
(2)BF3的中心原子的杂化方式为_____________ ,与其互为等电子体的阴离子为__________ (填一种即可)。
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为__________ 。
(4)KBF4的阴离子空间构型为_________ 。
(5)三卤化硼的性质如下:
BF3、BCl3、 BBr3、BI3的沸点逐渐升高的原因是:________________________________ 。
(6)指出图中代表硼原子的字母为_________ ,该KBBF晶体的晶胞参数分别为apm和cpm, α=β=γ=90°, 则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏伽德罗常数的值,列出计算式)。

回答下列问题:
(1)基态钾原子的核外电子排布式为
(2)BF3的中心原子的杂化方式为
(3)氟代硼铍酸钾晶体KBBF(KBe2BO3F2)组成元素中电负性最大的元素和电负性最小的元素组成的物质为
(4)KBF4的阴离子空间构型为
(5)三卤化硼的性质如下:
BF3 | BCl3 | BBr3 | BI3 | |
熔点/°C | -127 | -107 | -46 | 49.9 |
沸点/°C | -99 | 12.5 | 91.3 | 210 |
(6)指出图中代表硼原子的字母为
您最近一年使用:0次
名校
解题方法
2 . 钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为____ ,Co的第四电离能比Fe的第四电离能要小得多,原因是____ 。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有____ mol配位键,图2中C原子的杂化方式为____ ,形成上述两种化合物的四种元素中电负性最大的是____ (填元素符号)。
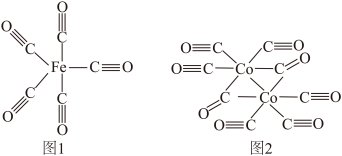
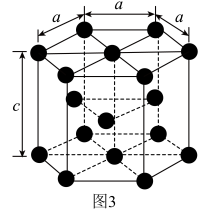
(3)金属钴的堆积方式为六方最密堆积,其配位数是____ ,钴晶体晶胞结构如图3所示,该晶胞中原子个数为____ ;该晶胞的边长为anm,高为cnm,该晶胞的密度为____ (NA表示阿伏加 德罗常数的值,列出代数式)g·cm-3。
(1)Co2+的核外电子排布式为
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有


(3)金属钴的堆积方式为六方最密堆积,其配位数是
您最近一年使用:0次
2020-03-25更新
|
165次组卷
|
4卷引用:陕西省2020届高三3月线上联考理综化学试题
陕西省2020届高三3月线上联考理综化学试题湖南2020年2月高三线上联考(全国I卷)理综化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编湖南省株洲市第一中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
3 . 铜及其化合物在很多领域有重要的用途,如氧化亚铜(Cu2O)可做半导体材料,胆矾(CuSO4·5H2O)用于杀菌剂,磷酸氧铜[Cu4O(PO4)2]能充当电极的活性物质。请回答下列相关问题。
(1)写出基态Cu+离子的核外电子排布式____________________ ,与Cu同周期且与Cu原子最外层电子数相等的元素有______________________ (填元素符号)。
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为______________________ 。
(3)PO43-的VSEPR模型为______________________ ,中心原子P的杂化类型为___________ ,与其互为等电子体的离子有______________________ (写出两种)。
(4)胆矾(CuSO4• 5H2O)的结构示意图如下图,请结合示意图完成下列问题。
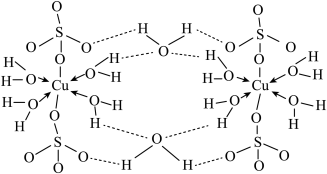

①将胆矾的化学式写成配合物的形式为______________________ 。
②胆矾中含有的微粒间作用力有______________________ (填序号)。
a.离子键b.极性键c.金属键d.配位键e.氢键f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的__________ (填“高”或“低”),原因是____________________ 。
②CuO的晶胞结构如上图所示,O2-的配位数是__________ 。
(1)写出基态Cu+离子的核外电子排布式
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为
(3)PO43-的VSEPR模型为
(4)胆矾(CuSO4• 5H2O)的结构示意图如下图,请结合示意图完成下列问题。


①将胆矾的化学式写成配合物的形式为
②胆矾中含有的微粒间作用力有
a.离子键b.极性键c.金属键d.配位键e.氢键f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的
②CuO的晶胞结构如上图所示,O2-的配位数是
您最近一年使用:0次
4 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
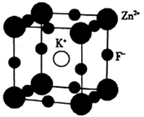
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近一年使用:0次
2018-01-07更新
|
409次组卷
|
6卷引用:陕西省榆林市2018届高三第二次模拟考试理综化学试题
解题方法
5 . X、Y、Z、W、M、Q、R六种元素均位于前四周期,且原子序数依次增大。其相关信息如下:X的核外电子总数等于其电子层数;Y的最外层电子数是次外层的3倍;Z原子的价层电子排布为nsn-1npn-2;Q的外围电子排布为(n+1)d4n(n+2)sn; W、M、R最外层电子只有1个。回答下列问题:
(1)Q元素位于周期表第_____ 族。Q金属配合物Q(CO)n的中心原子的价电子数与配体提供的电子总数之和为18,则n=_____ 。M的一种重要化合物用于检查司机是否酒驾,该化合物的化学式______ ,如果司机酒驾检查时该物质显示的颜色变化是_____________________ 。
(2)关于R单质晶体的说法正确的是______________ 。
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC•••‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
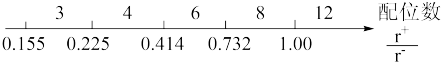
已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见_______ 晶体(填写化学式)阴阳离子的配位数相同。与阴(阳)离子配位的这几个阳(阴)离子,在空间构成的立体形状为_______________ 。
(4)W的原子半径为r,其晶体的空间利用率______________ (用含r的表达式表示)。
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为___________ 。
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为______ ,中心原子的杂化方式为_____
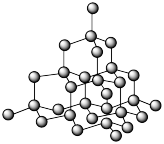
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是________ 个。
(1)Q元素位于周期表第
(2)关于R单质晶体的说法正确的是
①晶体中的化学键具有方向性和饱和性
②晶体中不存在阴阳离子间的相互作用
③晶体导电是因为在外加电场作用下产生自由电子
④单质具有光泽是因为金属阳离子吸收并放出可见光
⑤晶体中原子的堆积方式为‥ABCABC•••‥型。
(3)离子化合物中阴阳离子半径之比是决定晶体构型的重要因素之一,配位数与离子半径之比存在如下关系:
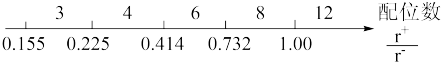
已知,在QY中Q离子的半径为70pm,Y离子的半径为140pm,分析以上信息,可以推导出该晶体结构与常见
(4)W的原子半径为r,其晶体的空间利用率
(5)已知SiH4在碱的催化作用下,剧烈发生水解,反应方程式为:SiH4 +(n+2)H2O= SiO2.nH2O + 4H2,已知每1mol SiH4水解反应中转移4mol电子,则C,H,Si三种元素的电负性由大到小的顺序为
(6)X射线衍射测定发现,I3AsF6中存在I3+离子,I3+离子的几何结构为
(7)已知金刚石中碳原子的连接方式如下图,则12g金刚石中含有的六元环的数目是

您最近一年使用:0次
名校
解题方法
6 . 氯磺酰氰酯(结构简式为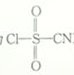 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是
(3)ClO4-的空间构型为
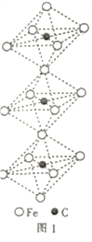
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为
您最近一年使用:0次
2018-05-25更新
|
267次组卷
|
3卷引用:2024届陕西省商洛市高三下学期第五次模拟检测理综试题-高中化学
2013·陕西延安·一模
名校
解题方法
7 . 2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答:
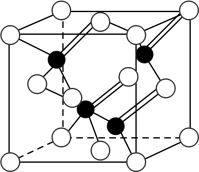
(1)镓的基态原子的电子排布式是_________________ 。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为___________ ,与同一个镓原子相连的砷原子构成的空间构型为______________ 。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是________ 。 (用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________ 。
(5)比较二者的第一电离能:As______ Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是_____________(填字母)。

(1)镓的基态原子的电子排布式是
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为
(5)比较二者的第一电离能:As
(6)下列说法正确的是_____________(填字母)。
| A.砷化镓晶胞结构与NaCl相同 | B.GaP与GaAs互为等电子体 |
| C.电负性:As>Ga | D.砷化镓晶体中含有配位键 |
您最近一年使用:0次
2016-12-09更新
|
996次组卷
|
3卷引用:2013届陕西省延安市秋高考模拟理综化学试卷
(已下线)2013届陕西省延安市秋高考模拟理综化学试卷2016-2017学年高中化学选修3(人教版)第三章 晶体结构与性质 章末检测新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题
解题方法
8 . 国产大飞机C919的制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)立方氮化硼硬度大,熔点为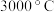 ,其晶体类型为
,其晶体类型为_______ 。
(2)耐高温材料立方 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂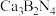 。
。
① 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为_______ 。
② 中
中 原子的
原子的_______ 轨道与 原子的
原子的_______ 轨道形成 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为_______ 。
③ 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是_______ 。
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有_______ (填字母)。 键 E.
键 E. 键 F.氢键
键 F.氢键
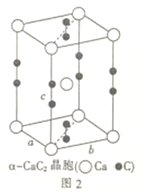
(4)硼化钙晶胞结构如图所示, 原子构成
原子构成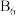 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个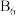 多面体围成立方体,中心为
多面体围成立方体,中心为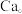 硼化钙的化学式为
硼化钙的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知 原子的分数坐标为
原子的分数坐标为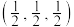 ,
,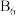 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
(1)立方氮化硼硬度大,熔点为
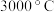 ,其晶体类型为
,其晶体类型为(2)耐高温材料立方
 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂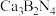 。
。①
 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为②
 中
中 原子的
原子的 原子的
原子的 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为③
 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有
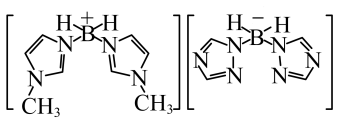
 键 E.
键 E. 键 F.氢键
键 F.氢键(4)硼化钙晶胞结构如图所示,
 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为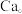 硼化钙的化学式为
硼化钙的化学式为 原子的分数坐标为
原子的分数坐标为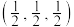 ,
,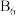 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为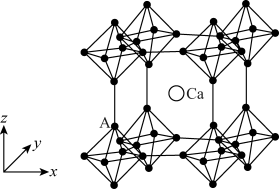
您最近一年使用:0次
解题方法
9 . CrSi、Ge-GaAs、ZnGeAs2、聚吡咯、碳化硅和氧化亚铜都是重要的半导体化合物。回答下列问题:
(1)基态铬原子的核外电子排布式为___________ ,其中未成对电子数为____________ 。
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为_______________ 。ZnGeAs2中 Zn、Ge、As 的电负性从大到小的顺序为________________ 。
(3) 聚吡咯的单体为吡咯( ),该分子中氮原子的杂化轨道类型为
),该分子中氮原子的杂化轨道类型为__________ ;分子中σ键与π键的数目之比为________________ 。
(4)碳化硅、晶体硅及金刚石的熔点如下表:
分析熔点变化规律及其差异的原因:__________________________________________________ 。
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。
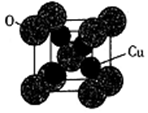
①氧化亚铜属于__________ 晶体。
②已知Cu2O的晶胞参数a=425.8pm,则其密度为__________ g·cm-3 (列出计算式即可)。
(1)基态铬原子的核外电子排布式为
(2) Ge-GaAs中元素Ge、Ga、As的第一电离能从大到小的顺序为
(3) 聚吡咯的单体为吡咯(
 ),该分子中氮原子的杂化轨道类型为
),该分子中氮原子的杂化轨道类型为(4)碳化硅、晶体硅及金刚石的熔点如下表:
| 立方碳化硅 | 晶体硅 | 金刚石 | |
| 熔点/℃ | 2973 | 1410 | 3550~4000 |
分析熔点变化规律及其差异的原因:
(5)氧化亚铜的熔点为1235℃,其固态时的单晶胞如下图所示。

①氧化亚铜属于
②已知Cu2O的晶胞参数a=425.8pm,则其密度为
您最近一年使用:0次
名校
10 . 芯片作为高科技产业,以及智能化、信息化、数字化的基础,自诞生以来就一直倍受关注。芯片制造要经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。回答下列问题:
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。
①镓为第四周期元素,基态Ga原子的核外电子排布式为:___________ ;
②将Mn掺杂到GaAs的晶体中替换部分Ga得到稀磁性半导体材料,晶体结构如甲图:___________ 。
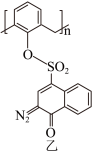
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其分子中S原子的杂化形式为___________ 。 )及清洗剂
)及清洗剂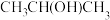 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为___________ ,HF分子的极性___________ (填“大于”、“等于”或“小于”)HCl,1mol 中含有
中含有___________ mol配位键。
(4)LiF晶体结构属于氯化钠型。
①LiF的熔点和沸点比NaCl的高,请解释原因:___________ 。
②LiF晶体的密度约为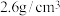 ,LiF晶胞的体积约为
,LiF晶胞的体积约为___________  (保留一位小数)。
(保留一位小数)。
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。
①镓为第四周期元素,基态Ga原子的核外电子排布式为:
②将Mn掺杂到GaAs的晶体中替换部分Ga得到稀磁性半导体材料,晶体结构如甲图:

(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其分子中S原子的杂化形式为
 )及清洗剂
)及清洗剂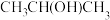 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为 中含有
中含有(4)LiF晶体结构属于氯化钠型。
①LiF的熔点和沸点比NaCl的高,请解释原因:
②LiF晶体的密度约为
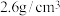 ,LiF晶胞的体积约为
,LiF晶胞的体积约为 (保留一位小数)。
(保留一位小数)。
您最近一年使用:0次



