名校
解题方法
1 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
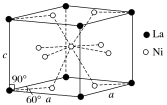
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题
陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题2016届安徽省安庆一中高三热身考试理综化学试卷2016届湖北省襄阳五中高三5月模拟三理综化学试卷四川省内江市2017届高三第五次模拟考试理综化学试题2016届河北省晋州一中高三上学期期末理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷苏教版2017届高三单元精练检测十一化学试题湖北省孝感市八校2018届高三上学期期末考试理综化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
名校
解题方法
2 . 硼材料及含硼化合物的用途非常广泛,如B(C6F5)3可代品Cu催化重氮化合物对杂环分子的修饰、催化吲哚与苯乙炔的区域选择性加成等。回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过___________ 的方法区分晶体与准晶体。
(2)B、C、F的电负性由大到小的顺序为___________ ;Be、B、C是同周期相邻元素,第一电离能: ,这是因为
,这是因为___________ 。
(3)B(C6F5)3分子中所有原子___________ (填“能”或“不能”)处于同一平面。
(4)吲哚(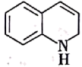 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是_________ 。
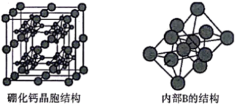
(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为___________ ,其晶体的密度为___________  (列出计算式)。
(列出计算式)。
(1)基态Cu原子的价电子排布式为
 是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过
是一种准晶体,具有与晶体相似的长程有序的原子排列,但是不具备晶体的平移对称性,可通过(2)B、C、F的电负性由大到小的顺序为
 ,这是因为
,这是因为(3)B(C6F5)3分子中所有原子
(4)吲哚(
 )的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是
)的沸点为253~254℃,苯乙炔的沸点为142~144℃,前者沸点高得多,其主要原因是(5)硼化钙的晶胞结构如图所示,晶胞参数为apm,设
 为阿伏加德罗常数的值。硼化钙的化学式为
为阿伏加德罗常数的值。硼化钙的化学式为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2021-11-23更新
|
194次组卷
|
3卷引用:陕西省榆林市第十中学2022届高三第五次模拟考试理综化学试题
解题方法
3 . 铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________ ,占据最高能级的电子的电子云轮廓图形状为___________ ,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________ 。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________ 。
(3)AlF3具有较高的熔点(1040℃),属于___________ 晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________ 。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________ ,该阴离子中存在的化学键有___________ (填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
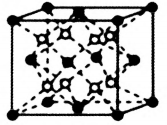
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________ 。立方体边长为acm,阿伏伽德罗常数的值为NA,则CaF2晶体的密度为___________ g·cm-3(列出计算式)
(1)基态铝原子的核外电子排布式为
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式
(3)AlF3具有较高的熔点(1040℃),属于
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为

您最近一年使用:0次
2018-12-05更新
|
653次组卷
|
3卷引用:陕西省西安市2019届高三化学试题
解题方法
4 . (1)基态Na原子中,核外电子占据的最高能层的符号是___________ ,占据该能层电子的电子排布式为______________________ 。
(2)三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。

①第一电离能:S___________ P(填“>”或“<”,下同),电负性:S___________ P。
②三硫化四磷分子中P原子采取___________ 杂化,与PO3-互为等电子体的化合物分子的化学式为___________ 。
(3)血红素是吡咯(C4H4N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示。

①1mol吡咯分子中所含的σ键总数为___________ 个。分子中的大π键可用 表示
表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______________________________________________________ 。
②血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过___________ 键相结合。
(4)晶体锌和镉都是体心立方结构,如图所示。

①镉晶体的配位数为___________ 。
②已知锌晶体的密度为dg·cm-3,NA代表阿伏伽德罗常数的值。锌晶体中锌离子之间最近的核间距(D)=___________ nm。
(2)三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。

①第一电离能:S
②三硫化四磷分子中P原子采取
(3)血红素是吡咯(C4H4N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示。

①1mol吡咯分子中所含的σ键总数为
 表示
表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为②血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过
(4)晶体锌和镉都是体心立方结构,如图所示。

①镉晶体的配位数为
②已知锌晶体的密度为dg·cm-3,NA代表阿伏伽德罗常数的值。锌晶体中锌离子之间最近的核间距(D)=
您最近一年使用:0次
5 . 镓 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_____ ,最高能级电子的电子云形状为_____ 。
(2)一种含镓药物的合成方法如图所示: 原子的杂化方式为
原子的杂化方式为_____ , 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为_____ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_____ (用元素符号表示)。
②化合物Ⅱ中 的配位数为
的配位数为_____ ,
_____ 。
(3)一种由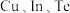 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。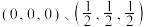 。则C点原子的分数坐标为
。则C点原子的分数坐标为_____ 。
② 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为_____ (用含 的代数式表示)
的代数式表示) 。
。
 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)一种含镓药物的合成方法如图所示:

 原子的杂化方式为
原子的杂化方式为 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为②化合物Ⅱ中
 的配位数为
的配位数为
(3)一种由
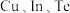 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。
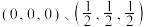 。则C点原子的分数坐标为
。则C点原子的分数坐标为②
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
名校
解题方法
6 . 镁、铝、铁、铜及其化合物在生产生活中具有广泛的应用。
(1)基态铝原子核外电子占据的最高能级符号为____ ,该能级原子轨道数为____ ,电子云轮廓图为_____ ;基态铁原子价层电子未成对电子数为_____ 。
(2)第一电离能镁_____ 铝(填>、<、=)
(3)CuSO4·5H2O俗名胆矾矾,可用于配制农药和游泳池消毒,其组成可表示为[Cu(H2O)4]SO4·H2O。晶体中含有的化学键类型为_______
a.离子键 b.共价键 c.配位键 d.氢键 e.金属键
(4)FeSO4·7H2O俗称绿矾,在空气中加热分解可能得到Fe2O3、H2O、SO2、SO3等,其中CuO的熔点为1026℃。
①H2O分子中氧原子的杂化类型是______ ,分子的立体构型是_____ 。组成绿矾的元素中电负性最大的元素是______ ,
②CuO的晶体类型是_____ 。
③SO2与SO3中,属于非极性分子的是______ ,SO2在溶剂水与溶剂CCl4中,相同温度能溶解更多SO2的溶剂是________
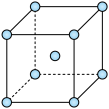
④铁的晶胞结构如图,若晶胞参数为acm,阿伏加德罗常数值为NA,则晶体的密度为___________ g/cm3。
(1)基态铝原子核外电子占据的最高能级符号为
(2)第一电离能镁
(3)CuSO4·5H2O俗名胆矾矾,可用于配制农药和游泳池消毒,其组成可表示为[Cu(H2O)4]SO4·H2O。晶体中含有的化学键类型为
a.离子键 b.共价键 c.配位键 d.氢键 e.金属键
(4)FeSO4·7H2O俗称绿矾,在空气中加热分解可能得到Fe2O3、H2O、SO2、SO3等,其中CuO的熔点为1026℃。
①H2O分子中氧原子的杂化类型是
②CuO的晶体类型是
③SO2与SO3中,属于非极性分子的是
④铁的晶胞结构如图,若晶胞参数为acm,阿伏加德罗常数值为NA,则晶体的密度为

您最近一年使用:0次
7 . 镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为______ ,基态Ga原子核外有_______ 个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____ 和+3。砷的电负性比镓_____ (填“大”或“小”)。
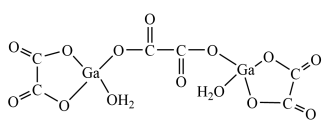
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为____ 。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为________ 。
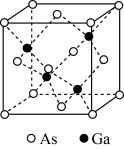
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以_______ 键键合。Ga和As的原子半径分别为apm和bpm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______ (列出计算式,可不化简)。
(1)基态N原子的核外电子排布式为
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以

您最近一年使用:0次
2019-03-14更新
|
531次组卷
|
4卷引用:【校级联考】陕西省汉中市重点中学2019届高三下学期3月联考理科综合化学试题
【校级联考】陕西省汉中市重点中学2019届高三下学期3月联考理科综合化学试题【省级联考】甘肃、青海、宁夏回族自治区2019届高三上学期期末联考理科综合化学试题(已下线)《2019年高考总复习巅峰冲刺》专题12 物质结构与性质应试策略2020届高考化学二轮复习大题精准训练 ——物质结构与性质选做题
解题方法
8 . 羰基钻催化剂可在温和条件下催化氢甲酰化反应,其结构为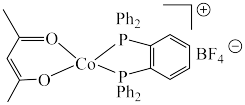 (Ph代表苯基)。回答下列问题:
(Ph代表苯基)。回答下列问题:
(2)羰基钴催化剂中位于第二周期的元素中,电负性由小到大的顺序为
 的晶体类型相同,
的晶体类型相同, 的熔点高于羰基钴催化剂的原因是
的熔点高于羰基钴催化剂的原因是(3)羰基钴催化剂阳离子中Co处于平面四边形中心,羰基钴催化剂中采取
 杂化的元素种数为
杂化的元素种数为 形成羰基钴催化剂过程中,
形成羰基钴催化剂过程中,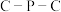 键角
键角(4)一种掺Co催化剂的晶胞结构及晶胞沿面对角线投影如下图所示。晶胞中与Co最近的氧原子所构成的几何形状为
 ,晶体的密度为
,晶体的密度为 ,则距离最近的两个氧原子间的距离为
,则距离最近的两个氧原子间的距离为 、
、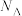 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-06-01更新
|
81次组卷
|
2卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学
9 .
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是___________ (写化学式)
(2)基态Cr3+的核外电子排布式为_____________________ 。
(3)配合物K[Cr(C2O4)2(H2O)中的配体是___________ ,C2O42-中碳原子的杂化轨道类型是___________ ,与H2O互为等电子体的离子是___________ (任写一种)
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是___________ (填标号)。

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为___________ 。
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为___________ pm。
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为___________ g·cm-3;晶胞中Cr4+位于O2-所形成的正八面体的体心,该正八面体的边长为___________ pm。
翡翠的主要成分为 NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅。
(1) NaAlSi2O6所含元素中,第一电离能最小的元素和电负性最大的元素组成的含有两种化学键的化合物是
(2)基态Cr3+的核外电子排布式为
(3)配合物K[Cr(C2O4)2(H2O)中的配体是
(4)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是

a.氟化钙 b.金刚石 c.钠 d.氯化铯
(5)Ca、O、Gr可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示,其中Ca2+,O2-采用面心立方最密堆积方式。
①该晶体的化学式为
②已知钙离子、氧离子半径分别为100pm、140pm,该晶胞的参数(边长)为
③阿伏伽德罗常数的值为NA,该晶体密度的计算表达式为
您最近一年使用:0次
2018-12-13更新
|
411次组卷
|
3卷引用:陕西省宝鸡市陈仓区2021届高三第二次教学质量检测理科综合化学试题
10 . Fe—Cr—Si系合金是一种新型耐磨耐腐蚀的材料,具有较好的发展前景。按要求回答下列问题。
(1)基态Cr2+与Fe的未成对电子数之比为___ 。试从电子排布角度分析水溶液中Fe2+具有强还原性___ 。若是形成将其转化为(NH4)2Fe(SO4)2,在空气中相对稳定, 的空间构型为
的空间构型为___ 。
(2)由环戊二烯(C5H6,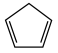 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知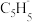 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为___ ,结构中的大π键可用符号表示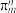 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为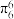 )。则
)。则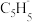 结构中含有的大π键可表示为
结构中含有的大π键可表示为___ 。
(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为___ 。几种Cr的卤化物的部分性质如表所示:
试预测CrBr3的熔点范围___ 。
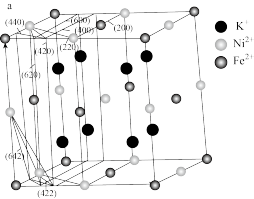
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-___ 个。该物质常用于吸附Cs+,将取代晶胞中的K+,取代后的物质的化学式为___ 。
(1)基态Cr2+与Fe的未成对电子数之比为
 的空间构型为
的空间构型为(2)由环戊二烯(C5H6,
 )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知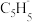 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为
的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为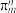 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为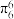 )。则
)。则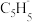 结构中含有的大π键可表示为
结构中含有的大π键可表示为(3)某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为
| 卤化物 | CrCl3 | CrBr3 | CrI3 |
| 熔点/℃ | 1150 | 600 |
(4)某晶体中含有K+、Ni2+、Fe2+、CN-,其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-

您最近一年使用:0次



